Общеизвестно, что церебральное перфузионное давление (ЦПД) определяется как разница между средним артериальным (САД) и средним внутричерепным давлениями (ВЧД): ЦПД = САД – ВЧД и измеряется в миллиметрах ртутного столба (мм рт.ст.).
Очень часто клиницисты путают понятия ЦПД и перфузия головного мозга. Что же такое перфузия и почему давление называется перфузионным?
Перфузия – это процесс прохождение крови через ткань или орган. Перфузию оценивают как отношение потока жидкости сквозь ткань к массе этой ткани. В нашем случае перфузия – это отношение объемного мозгового кровотока к массе мозгового вещества. Она измеряется в миллилитрах крови на 100 гр. ткани в минуту (мл/ 100 г/ мин). Усредненный объемный мозговой кровоток в физиологических условиях приблизительно равен 50 мл/100г/мин. Существуют региональные отличия для серого и белого вещества мозга, которые варьируют от 70 до 20 мл/100г/мин., соответственно. Нижние границы мозгового кровотока, при которых развиваются гипоперфузия и церебральная ишемия, хорошо изучены и установлены в экспериментальных работах: мозговой кровоток менее 30мл/100г/мин вызывает развитие неврологической симптоматики и изменение функциональной активности нейронов; при снижении до 15-20 мл/100 г/мин развиваются обратимые нарушения на уровне дисфункции мембран нейронов; при снижении кровотока менее 10-15 мл/100г/мин развивается необратимые нейрональное повреждение и гибель нейронов [1;9;10;32]. Однако, следует помнить, что развитие деструктивных морфологических изменений в мозговой ткани зависит не только от степени, но и от длительности ишемии [11;32].
В гидродинамике, как и в электродинамике для расчета силы тока (жидкости или электричества) используется закон Ома I=U/R. В электродинамике – это отношение напряжения или разности потенциалов к сопротивлению, а в гидродинамике – это отношение разности давлений в начале и конце трубки, или системы трубок, к сопротивлению. Таким образом, объемная скорость жидкости прямо пропорциональна разнице давлений и обратно пропорциональна гидродинамическому сопротивлению. Разность давлений, или градиент давлений, создающий поток крови через ткань и называют перфузионным давлением. В тканях организма перфузионное давление определяется градиентом давлений между артериальным и венозным руслом. В клинической практике мы используем ЦПД, как суррогатный показатель перфузии мозга, в виду отсутствия других доступных методов измерения. В соответствии с законом Ома перфузия мозга, или объемный мозговой кровоток, описывается формулой CBF = СРР / CVR, где CBF- объемный кровоток, СРР - церебральное перфузионное давление, CVR- сопротивление церебральных сосудов [2; 9].
В нормальных физиологических условиях ВЧД близко к давлению венозных синусах мозга, поэтому ЦПД при нормальном состоянии приравнивается артерио-венозному градиенту. При патологических состояниях мозга сопровождающихся повышенным давлением в полости черепа: отеке мозга, нарушении циркуляции ликвора, появлении патологического масс-эффекта - происходит компрессия вен в местах впадения в синусы мозга. Все это приводит к нарушению венозного оттока и, в конечном счете, способствует дальнейшему росту ВЧД. При этом ВЧД значительно превосходит давление в венозных синусах мозга. В создавшихся условиях перфузия ткани мозга будет зависеть от градиента между САД и ВЧД.
Измерение ЦПД возможно при условии измерения артериального и внутричерепного давления. В условиях отделений нейроинтенсивной терапии данные измерения проводятся прикроватного, инвазивно и в непрерывном режиме. Общеизвестно, что для расчета ЦПД используют среднее артериальное давление (САД). Установлено, что САД определяет перфузию тканей организма и остается относительно неизменным на всем протяжении артериального русла [6;42]. Для правильного измерения ЦПД при горизонтальном положении тела датчик измерения инвазивного АД должен располагаться на уровне левого предсердия. При положении тела с приподнятым головным концом датчик должен размещаться на уровне наружного слухового прохода. Так обеспечивается положение датчика на уровне Виллизиева круга сосудов головного мозга, что гарантирует более точное измерение ЦПД [3;41]. Если в положении приподнятого головного конца под углом 15-450 расположить датчик инвазивного артериального давления на уровне левого предсердия, то может происходить искусственное завышение ЦПД на 10-20 мм рт.ст. так как свой вклад будет вносить возросший уровень гидростатического давления. Неправильное измерение ЦПД может влиять на принятие решения о терапии, затруднять своевременную диагностику гипо- и гиперперфузии мозга и, как следствие, ухудшать исходы заболевания [41].
Закон Ома позволяет считать ЦПД суррогатным маркером мозгового кровотока [2;9]. Другим не менее значимым фактором, определяющим интенсивность объёмного мозгового кровотока, является сопротивление церебральных сосудов. В норме, у здорового человека работают механизмы ауторегуляции тонуса мозговых сосудов. В соответствии с уравнением Ома, ауторегуляция обеспечивает адекватное сопротивление мозговых сосудов в ответ на изменения ЦПД и, тем самым, поддерживает постоянство объемного кровотока, отвечая метаболическим потребностям мозга [1; 2; 9]. Ауторегуляция тонуса мозговых сосудов – сложный многокомпонентный физиологический механизм регуляции тонуса мозговых сосудов, обеспечивающий адекватность церебрального кровотока, оксигенации и метаболизма. В основе ауторегуляции лежит способность гладкомышечных клеток регионарных сосудов к повышению сократительной активности при увеличении растяжения сосудов под действием перфузионного давления или к ее уменьшению при ослаблении растяжения в условиях снижения перфузионного давления. Основные компоненты ауторегуляции мозговых сосудов – это миогенный, гуморальный, метаболический, нейрогенный, эндотелиальный [1;2;4;5;9].
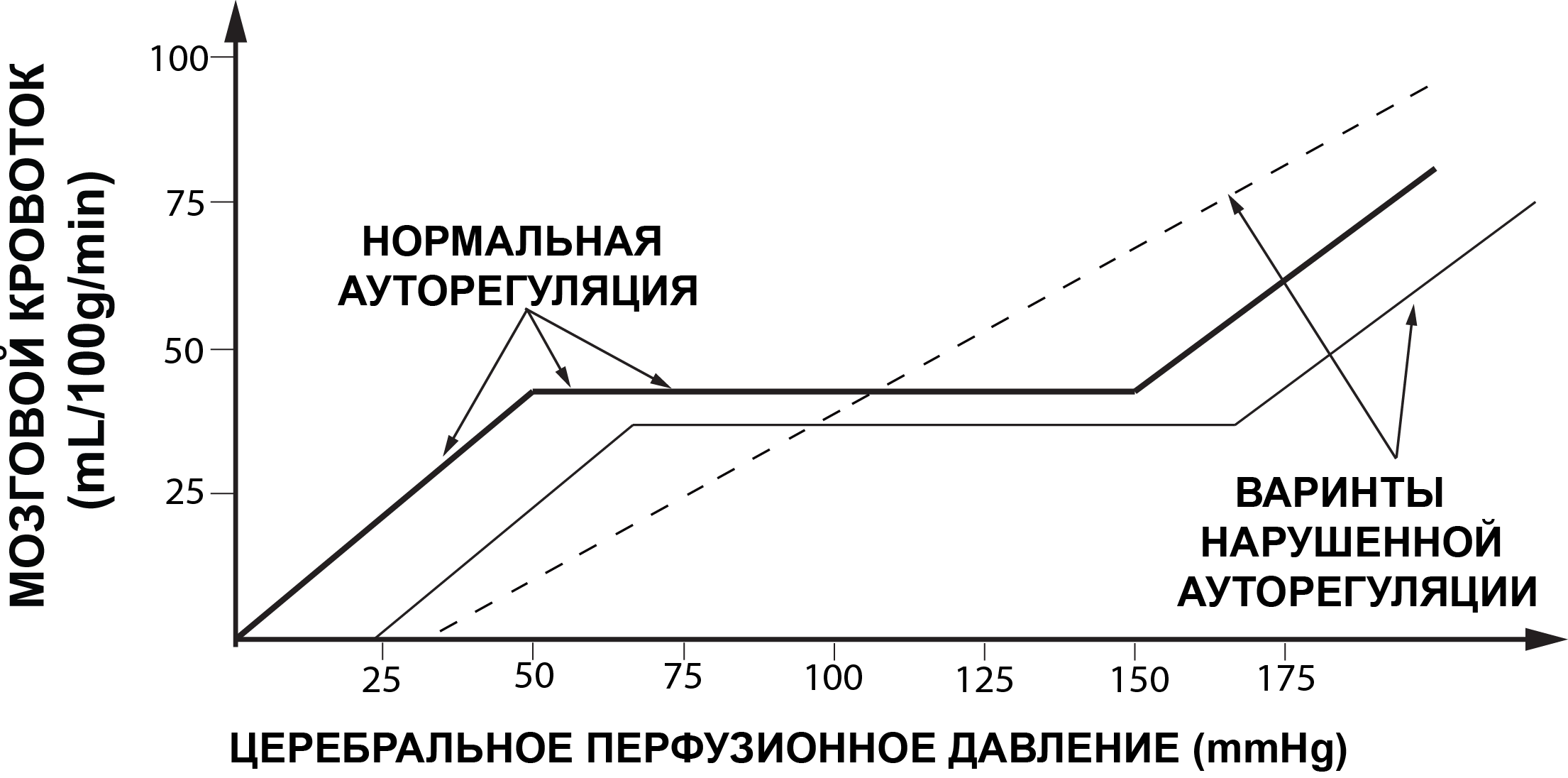
При нормальных физиологических условиях границы ЦПД (Рис. 1) здорового человека лежат в пределах от 50 до 150мм рт.ст.[43]. В пределах указанных границ ЦПД обеспечивается постоянный адекватный объемный мозговой кровоток. Снижение ЦПД ниже 50 мм рт.ст. может приводить к ишемии мозга, а повышение ЦПД выше 150 мм рт.ст. - к гиперемии мозга (Рис. 2).
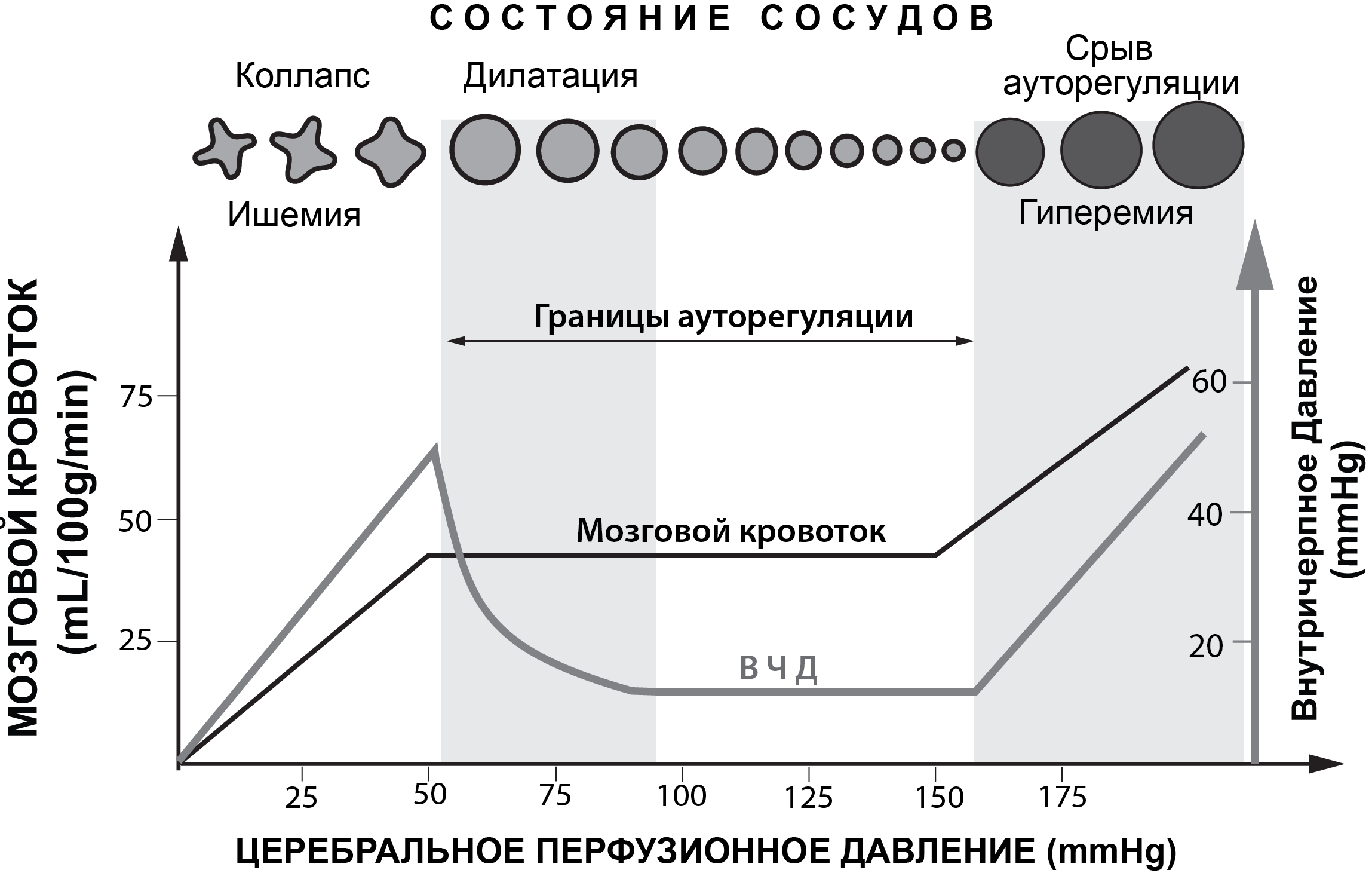
При различных патологических состояниях головного мозга (ЧМТ, САК, ОНМК) ауторегуляция мозговых сосудов может нарушаться. Это означает, что резистивные сосуды плохо обеспечивают постоянство объемного кровотока на фоне изменяющегося АД, изменения газового состава ткани мозга и крови и т.д. В этих патологических условиях мозговой кровоток напрямую зависит от значения ЦПД.
Церебральная ишемия, развивающаяся в остром периоде ЧМТ, остается одним из важных факторов вторичного повреждения мозга, который определяет исход травмы [25;38]. Поддержание церебрального перфузионного давления (ЦПД) у пострадавших с ЧМТ является общепризнанным методом предупреждения развития вторичной ишемии мозга. Согласно данным мировой литературы, ЦПД является независимым прогностическим критерием исхода при ЧМТ [18;37]. Основной причиной снижения церебральной перфузии при ЧМТ является артериальная гипотония. Устранение причин гипоперфузии введено в стандарт оказания первой помощи пострадавших с ЧМТ[29]. Подходы к контролю и обеспечению ЦПД претерпевали изменения, начиная с внедрения первых протоколов лечения пострадавших с ЧМТ. В 60-70-х годах, когда был внедрен мониторинг ВЧД по методу Lunberg, измерению ЦПД не предавалось должного внимания. Основной задачей при ведении пострадавших с ЧМТ считалась коррекция ВЧД. Самый ранний ВЧД-протокол включал в себя такие терапевтические опции, как наружное вентрикулярное дренирование ликвора, гипервентиляцию, использование седативных препаратов, релаксантов, гиперосмолярных растворов и декомпрессивной трепанации [29;36;37;38].
В середине 80-х годов появилась новая концепция ведения пациентов с травматическим поражением головного мозга. В основе концепции, предложенной Rosner et al., лежал каскад вазодилатации и вазоконстрикции. Данная концепция послужила развитию нового направления терапии пострадавших с травматическим поражением головного мозга, а именно, ЦПД-протоколу [48;49;50;51]. По мнению Rosner et al., при ЧМТ границы ауторегуляции мозговых сосудов «смещаются вправо» к более высоким значениям ЦПД. Суть концепции заключается в том, что не зависимо от причин, приводящих к снижению ЦПД, это всегда приводит к вазодилатации мозговых сосудов и увеличению объемного кровотока (внутричерепного содержания крови). Это в свою очередь вызывает повышение ВЧД, что закономерно приводит к дальнейшему снижению ЦПД и, таким образом, причинно-следственный каскад замыкается и повторяется вновь и вновь, приводя к ишемическому повреждение головного мозга. Для разрыва данного патологического круга достаточно повысить перфузионное давление, что приведет к вазоконстрикции мозговых сосудов, уменьшению объемного кровотока и снижению ВЧД. Согласно концепции авторов, для обеспечения адекватного мозгового кровотока и контроля над ВЧД, необходимо поддерживать более высокие значения ЦПД. В дальнейшем ЦПД - протокол был включен в первое международное руководство по ведению ЧМТ и сводился к поддержанию ЦПД выше 70 мм рт.ст. Поддержание ЦПД обеспечивалось инфузионной терапией и введением катехоламинов. Внедрение ЦПД-протокола обеспечило снижение летальности в группе пострадавших с тяжелой ЧМТ с 50% до 35-26% [36;49;55]. Интересно отметить, что с момента внедрения первого ЦПД – протокола и по сегодняшний день произошел пересмотр границ безопасного ЦПД (Таблица №1).

Если на ранних этапах развития делался акцент только на нижние границы допустимого ЦПД, ниже которого считалось нельзя допускать снижения ЦПД из-за риска развития церебральной ишемии, то в настоящее время обсуждается и необоснованность агрессивного обеспечения высоких значений ЦПД. Это обусловлено риском развития различных интра - и экстракраниальных осложнений [15;19].
Альтернативным протоколом по значению безопасного уровня ЦПД является протокол Лунд. Данный протокол, ориентирован на контроль ВЧД. Основной целью протокола является управление внутричерепными объемами за счет снижения транскаппилярной фильтрации, обеспечения целостности гемато-энцефалического барьера, снижения метаболизма мозга, нормализации тонуса прекаппилярных артериол, поддержания коллоидно-онкотического давления. Согласно концепции, высокое АД и повышенное ЦПД являются потенциально опасными, так как провоцируют отек мозга за счет усиления транскаппилярной фильтрации. Терапия ориентирована на снижение АД и понижение ЦПД до 50 мм рт.ст. Обеспечение безопасного уровня ЦПД авторы подтверждали с помощью церебрального микродиализа, контролируя уровень метаболизма мозга [21;26;27]. Разработчики Лунд-протокола утверждали, что он обеспечивает снижение летальности (до 8%) и увеличивает количество благоприятных исходов (до 80%)[21].
Итак, Лунд-протокол был ориентирован на снижение ВЧД< 20 мм рт.ст. и обеспечение ЦПД в пределах 50-60 мм рт.ст. Несмотря на значительные расхождения по ЦПД между существовавшими протоколами, в третьей редакции международных рекомендаций по ведению пострадавших с ЧМТ, были пересмотрены и снижены границы ЦПД, внесено ограничение по агрессивному поддержанию ЦПД (Таблица №1). В проспективном исследовании, проведенном Robertson et al., авторы сравнили два уровня обеспечения ЦПД. Одной группе пострадавших с ЧМТ обеспечивали ЦПД>50 мм рт.ст., а другой >70 мм рт.ст. В группе с ЦПД выше 70 мм рт.ст. значительно меньше было эпизодов церебральной ишемии, но при этом не было улучшения исходов заболевания. Авторы связали это с возросшим числом соматических осложнений, чаще в виде респираторного дистресс-синдрома [46].
Таким образом, не было подтверждено преимущество стратегии и положительного эффекта на исходы заболевания при агрессивном обеспечении ЦПД. По результатам этого и ряда других исследований были внесены поправки к существующим рекомендациям по обеспечению ЦПД. Важно отметить, что впервые был ограничен верхний предел ЦПД. Так, согласно последней редакции Guidelines [29], для большинства пострадавших с ЧМТ границы ЦПД должно находиться в пределах 50-70 мм рт.ст. У пострадавших с сохранной ауторегуляцией допускается ЦПД выше 70 мм рт.ст. [29]. ЦПД у пациентов с острым нарушением мозгового кровообращения по ишемическому типу (ОНМК).
Данных о динамике ЦПД и его прогностической значимости у пациентов с ОНМК в литературе практически не встречается. Основной причиной этого является низкая частота встречаемости жизненно угрожающего отека мозга с развитием дислокации. По данным литературы, одно из самых грозных осложнений в виде злокачественного отека при ОНМК в бассейне средней мозговой артерии (СМА) встречается в 10% случаев от всех ишемических инсультов [7;30]. Отсюда следует, что показания для мониторинга ВЧД и ЦПД возникают у этих больных нечасто. В публикациях посвященных интенсивной терапии пациентов с ОНМК неоднократно обсуждался вопрос об адекватности и пользе измерения ВЧД и ЦПД. Так сообщалось, что при полушарных инсультах отрицательная неврологическая симптоматика в виде нарушения сознания, развития гемипареза, афазии, анизокарии, могла развиваться на фоне нормальных значений ВЧД. Ряд авторов достаточно скептически относятся к целесообразности измерения ВЧД и ЦПД при ОНМК и считают, что на данные параметры нельзя ориентироваться при определении лечебной тактики [23;52]. При развитии обширного инфаркта мозга летальность среди пациентов достигала 70-80% даже на фоне мониторинга ВЧД/ЦПД и использовании всего арсенала средств интенсивной терапии: гипервентиляции, седативных препаратов, гиперосмолярных растворов и др. [13;30]. Мета-анализ, проведенный Vahedi et al., на основании трех многоцентровых рандомизированных контролируемых исследований посвященных декомпрессивной трепанации при полушарных инсультах показал, что активная нейрохирургическая тактика снижает летальность и улучшает функциональный исход [54]. Наряду с этим, было сделано важное заключение, что мониторинг ВЧД не влиял на принятие решения о декомпрессивной трепанации. Было так же установлено, что дислокация мозга и неврологическое ухудшение могли развиваться на фоне нормальных значений ВЧД и ЦПД. Таким образом, была показана низкая чувствительность ВЧД мониторинга при выявлении дислокации на фоне ОНМК [54]. В современных рекомендациях по ведению пациентов с ишемическим инсультом основным параметром, обеспечивающим адекватность церебральной гемодинамики, принято считать АД. Артериальная гипотензия при ОНМК встречается редко [17;34]. Установлено, что критическими значениями при ОНМК является АД 100/70 мм рт.ст. [17].
Как следует из вышесказанного, в современной литературе безопасные границы ЦПД при ОНМК не обсуждаются. Это связано с небольшой частотой развития внутричерепной гипертензии у этой категории больных. Злокачественный отек мозга развивается только в 10% случаев от всех инсультов и только при обширных полушарных инфарктах мозга. При данной патологии консервативные методы терапии, ориентированные на ВЧД мониторинг, оказались неэффективными в отличии от декомпрессивной трепанации. В остром периоде ОНМК чаще регистрируется артериальная гипертензия. В международных рекомендациях по лечению больных с инсультом обсуждаются только предельные границы АД, а не границы ЦПД [28]. Так, рекомендуется проводить коррекцию АД только при значениях выше 220/120 мм рт.ст. Коррекция артериальной гипертензии первые 24 часа с момента развития инсульта не должна превышать 15% от исходного значения АД. При показании к внутривенному тромболизису, перед его проведением рекомендуется снизить АД ниже 185/110 мм рт.ст., а после проведения контролировать значение в диапазоне <180/105 мм рт.ст. При невозможности обеспечения указанных значений АД рекомендуется отказаться от проведения тромболизиса из-за риска кровоизлияния [28].
В доступной нам литературе не удалось оценить частоту развития внутричерепной гипертензии при данной патологии. Однако острота развития масс-эффекта, которая всегда присутствует при ВМК, с последующей дислокацией мозга требуют от нейроинтенсивиста тщательной клинической оценки, мониторинга церебральных параметров ВЧД/ЦПД и выполнения современных рекомендация. Ряд авторов полагает, что частота развития внутричерепной гипертензии у этого контингента больных сопоставима с её частотой при тяжелой ЧМТ [22;57]. В современных руководствах по ведению пациентов с ВМК рекомендовано контролировать ЦПД в пределах 50-70 мм рт.ст. и учитывать состояние ауторегуляции мозговых сосудов [40]. Данные рекомендации практически полностью повторяют рекомендации при тяжелой ЧМТ [29]. Важно отметить, что, как и у пациентов с ишемическим инсультом, при данной патологии острый период чаще сопровождается артериальной гипертензией [44;56].
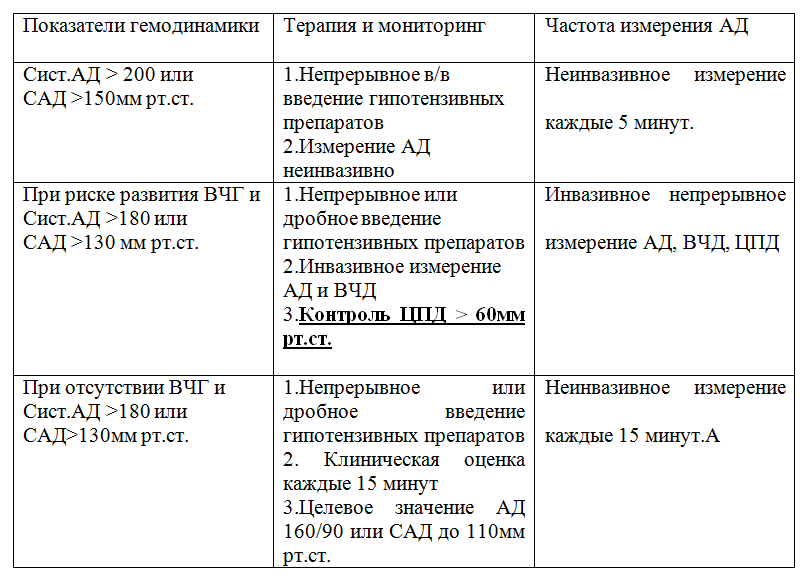
Именно поэтому в рекомендациях в основном обсуждаются верхние границы безопасного АД (Таблица №2): Коррекция артериальной гипертензии проводится незамедлительно и агрессивно при значении систолического АД > 220 или среднего АД (САД) > 150 мм рт.ст. При развитии отека мозга и систолического АД> 180 и САД> 130 мм рт.ст. коррекция гемодинамики должно проводиться под контролем ВЧД и обеспечения ЦПД>60 мм рт.ст. При отсутствии признаков внутричерепной гипертензии, проводится контроль АД, целевым значением становиться АД 160/90 и САД <110 мм рт.ст. У пациентов после декомпрессивной трепанации САД должно быть <100 мм рт.ст. [16; 40].
Стремление клиницистов незамедлительно купировать артериальную гипертензию обусловлено тем, что высокое АД может увеличивать объем кровоизлияния, перифокальный отек вокруг гематомы за счет повышенного гидростатического давления, способствовать повторному кровоизлиянию и, в конечном итоге, ухудшать исход заболевания. В остром периоде ВМК ориентиром для гипотензивной терапии служит уровень безопасного АД. В многочисленных исследованиях при данной патологии предпочтение было отдано контролю систолического АД, так как в отличие от диастолического и САД, оно зарекомендовало себя как надежный фактор предсказания повторного кровоизлияния [44]. Принято считать, что при геморрагическом инсульте высокое АД можно безопасно снижать до уровня систолического АД 140 мм рт.ст. без риска развития гипоперфузии [8]. Но при этом, согласно международным рекомендациям для пациентов с ВМК, границы ЦПД должны находиться в пределах 50-70 мм рт.ст., а при развитии отека и внутричерепной гипертензии ЦПД должно строго контролироваться в пределах выше 60 мм рт.ст.[40]. Таким образом, при лечении пациентов с ВМК наряду с коррекцией артериальной гипертензии, важным аспектом терапии является обеспечение адекватного ЦПД. ЦПД у пациентов с аневризматическим субарахноидальным кровоизлиянием (САК). При рассмотрении данной патологии следует учитывать ряд особенностей в зависимости от сроков с момента кровоизлияния и наличия вазоспазма. Согласно данным литературы частота внутричерепной гипертензии (ВЧГ) при данной патологии весьма вариабельна и составляет от 10 до 54%. Причем внутричерепная гипертензия имеет различные первопричины и может формироваться на разных этапах [31;35].
Первоначально при разрыве аневризм внутричерепная гипертензия развивается в момент прорыва крови из артериального русла. Выраженность внутричерепной гипертензии зависит от объема кровоизлияния, сопутствующего нарушения ликвородинамики, возможности пространственной компенсации краниоспинального пространства. В последующем, в остром периоде, развитие внутричерепной гипертензии может быть связано с гидроцефалией. Начиная с 4-7 суток, после кровоизлияния, ВЧГ может формироваться за счет ишемического отека мозга, как осложнение церебрального вазоспазма. Гипоперфузия мозговой ткани может развиваться на любом из этих этапов заболевания. Безопасные границы АД и ЦПД зависят от 2-х факторов: выключена аневризма или нет, а так же от наличия церебрального вазоспазма. В соответствие с международными рекомендациями у этих больных следует исключить эпизоды артериальной гипотензии менее 100 мм рт.ст. в течение первых 21 суток с момента кровоизлияния. До момента клипирования или эндовазальной эмболизации аневризмы следует контролировать систолическое АД - не выше 160 мм рт.ст. [12]. При развитии церебрального вазоспазма агрессивность интенсивной терапии возрастает и одним из важных ориентиров терапии помимо АД, становится ЦПД. Следует оговориться, что в дальнейшем речь пойдет о самых тяжелых пациентах с оценкой по шкале Хант-Хесс IV-V. Именно у этой группы пациентов чаще развивается вазоспазм, гипоперфузия и церебральная ишемия, они нуждаются в строгом контроле АД и ЦПД. До начала расширенного мониторинга (АД, ЦПД, ВЧД) рекомендуется контролировать среднее АД выше 90 мм рт.ст. С момента начала мониторинга ВЧД/ЦПД целью терапии становиться обеспечение ЦПД выше 70 мм рт.ст. [33;39;47].
Таким образом, контроль ЦПД при САК становиться актуальным только для группы пациентов с высоким риском развития вазоспазма или уже развившимся вазоспазмом мозговых сосудов. Контроль АД и обеспечение ЦПД выше 70 мм рт.ст. принято считать одним из эффективных методов профилактики церебральной ишемии у пациентов с САК [14;47].
ЦПД не может считаться универсальным показателем адекватности мозгового кровотока при различной церебральной патологии.
С целью профилактики и направленной терапии церебральной ишемии целесообразно использовать показатель ЦПД при развитии внутричерепной гипертензии и риске развития церебральной гипоперфузии.
ЦПД имеет приоритетное значении при лечении пациентов с ЧМТ, а так же у пациентов с САК (Хант-Хесс 4-5) и пациентов с ВМК.
Для пациентов с ОНМК и САК (Хант-Хесс 1-3) предпочтение отдается контролю АД.
Ткаченко Е.В., Горячев А.С., Павлов В.Е., Климов И.А., Лукьянец О.Б.
Захарова Н.Е., Потапов А.А., Корниенко В.Н., Пронин И.Н., Зайцев О.С., Гаврилов А.Г., Фадеева Л.М., Ошоров А.В., Сычев А.А., Такуш С.В.
Потапов А.А., Захарова Н.Е., Пронин И.Н., Корниенко В.Н., Гаврилов А.Г., Кравчук А.Д., Ошоров А.В., Сычев А.А., Зайцев О.С., Фадеева Л.М., Такуш С.В.
Захарова Н.Е., Пронин И.Н., Потапов А.А., Корниенко В.Н., Зайцев О.С., Гаврилов А.Г., Кравчук А.Д., Ошоров А.В., Сычев А.А., Александрова Е.В., Фадеева Л.М., Такуш С.В., Полупан А.А.
Захарова Н.Е., Потапов А.А., Корниенко В.Н., Пронин И.Н., Зайцев О.С., Гаврилов А.Г., Кравчук А.Д., Ошоров А.В., Сычев А.А., Александрова Е.В., Фадеева Л.М., Такуш С.В., Полупан А.А.
Артериальная гипотензия (АГ) развивается у 68% пациентов с опухолями хиазмально-селлярной области (ХСО) при осложненном течении послеоперационного периода [1, 2]. Обычно она связана со снижением периферического сосудистого сопротивления и относительной гиповолемией. У трети пациентов развивается снижение сердечного выброса (СВ) вследствие брадикардии на фоне декомпенсированного гипотиреоза [14]. Исходя из этого, основными направлениями в коррекции АГ стало использование альфа-симпатомиметических препаратов в комбинации с достижением нормоволемии увеличением объема проводимой инфузии. У пациентов со сниженным СВ на фоне гипотиреоза целесообразно использование бета-симпатомиметических препаратов до его компенсации тиреоидными гормонами [14].
Границами нормального среднего артериального давления (АДср) принято считать 70 – 110 мм.рт.ст. Очевидно, что колебания АДср в этих пределах приведет к изменению церебрального перфузионнного давления (ЦПД), а также перфузии мозга только при нарушении ауторегуляции церебрального кровотока [17]. Поддержание адекватной перфузии мозга является актуальной задачей для раннего послеоперационного периода [17]. В настоящее время отсутствуют общепризнанные уровни среднего АД, достижение которых необходимо у пациентов с опухолями ХСО в послеоперационном периоде, как при развитии у них АГ, так и при формально нормальном уровне АД, но наличия осложненного варианта течения послеоперационного периода, при котором пациент нуждается в пребывании в отделении реанимации для проведения интенсивной терапии. Таким образом, целью проведенного исследования было определение критериев адекватного АДср у пациентов с опухолями ХСО и осложненным течением послеоперационного периода для улучшения исходов лечения.
Наше проспективное исследование проводилось на больных, оперированных в Институте нейрохирургии в период с января 2011 по январь 2012 года. Критерии включения: 1. взрослые пациенты; 2. опухоль ХСО; 3. ранний послеоперационный период (семь суток после операции); 4. осложненный послеоперационный период. Под осложненным послеоперационным периодом понималось состояние, при котором после операции требовалось замещение средствами и методами интенсивной терапии нарушенных функций жизненно важных органов и систем (коррекция измененного уровня сознания, АГ, дыхательной недостаточности, пареза желудочно-кишечного тракта, выраженных водно-электролитных и гормональных нарушений). Критерии исключения: 1. три балла по шкале комы Глазго (атоническая кома) на вторые сутки после операции; 2. острый инфаркт миокарда; 3. отек мозга, по данным КТ-исследования головного мозга; 4. ишемический инсульт в бассейне крупных артерий основания мозга (интраоперационное ранение артерий или другие причины их периоперационной окклюзии); 5. интракраниальное кровоизлияние. В исследование включались все последовательно поступавшие в отделение реанимации пациенты, удовлетворявшие критериям включения и имевшие осложненный послеоперационный период. Набор пациентов с неосложненным течением послеоперационного периода носил характер случайной выборки. Для проведения корректного статистического анализа количество этих пациентов было ограничено таким образом, чтобы оно было сопоставимо с численностью больных с осложненным течением послеоперационного периода.
Всем пациентам, включенным в исследование, в первые послеоперационные сутки проводилось спиральное КТ-исследование головного мозга аппаратом CereTom (Neurologica, USA). В дальнейшем КТ-исследования выполнялись по клиническим показаниям, но не реже одного раза в неделю. Проводился стандартный для отделения реанимации мониторинг функции жизненноважных органов и лабораторных показателей: неинвазивный или инвазивный (при развитии АГ) мониторинг АД, пульсоксиметрия, мониторинг внутрибрюшного давления, клинический анализ крови и мочи, биохимический анализ крови (электролиты. глюкоза, альбумин, общий белок, мочевина, креатинин, трансаминазы), анализ гормонального статуса. Кроме этого, всем пациентам ретроградно катетеризировалась внутренняя яремная вена так, чтобы дистальный конец катетера находился в луковице яремной вены. Осуществлялась рентгенологическая верификация положения катетера. Целью катетеризации внутренней яремной вены был забор оттекающей от мозга крови, сатурация (SjvO2) которой свидетельствует об адекватности мозгового кровотока метаболическим потребностям мозга (норма 60–80%). Центральный венозный катетер позиционировался таким образом, чтобы его дистальный конец при рентгенографии грудной клетки визуализировался в проекции правого предсердия. Это делалось для забора центральной венозной крови, сатурация (ScvO2) которой свидетельствует об адекватности перфузии органов их метаболическим потребностям (норма: 65-80%). Забор крови производился одновременно из луковицы внутренней яремной вены и правого предсердия. Исследование газового состава крови осуществлялось на газовом анализаторе ABL 800 FLEX (Radiometer, Copenhagen, Denmark). В каждой из проб регистрировались значения сатурации и лактата. Нормальным уровнем лактата как для крови, оттекающей от мозга (LACjv), так и центральной венозной крови (LACcv) считался 0,5-2,2 ммоль/л [8]. Все измерения венозной крови производились на фоне нормовентиляции (РаСО2 артериальной крови 35-45 мм.рт.ст.), нормооксии (раО2 80-100 мм.рт.ст.) и нормального уровня гемоглобина (Hb>8 г/дл). У пациентов с неосложненным течением послеоперационного периода исследования центральной венозной крови и крови, оттекающей от мозга, проводилось в течение первых послеоперационных суток, каждые 6 часов – на 6-ой, 12-ый, 18-ый и 24-ый час – всего 4 пары измерений. При каждом заборе крови регистрировалось АДср, на фоне которого оно производилось. У пациентов с осложненным течением послеоперационного периода, но стабильным АД, исследования центральной венозной крови и крови, оттекающей от мозга, проводилось в течение трех послеоперационных суток, каждые 6 часов (12 пар измерений). При каждом заборе крови регистрировалось АДср, на фоне которого оно производилось. Стабильным АД считался уровень АДср в пределах 70 – 110 мм.рт.ст. Соответственно, АГ считалось снижение АДср ниже 70 мм.рт.ст. АД корригировалось незамедлительно при развитии АГ [14]. У пациентов с осложненным течением послеоперационного периода и эпизодом АГ исследования центральной венозной крови и крови, оттекающей от мозга, проводилось на разных уровнях среднего АД: 70, 80, 90, 100, 110 мм.рт.ст. (5 пар измерений). Необходимое АДср достигалось изменением скорости инфузии альфа-симпатомиметических препаратов, введение которых проводилось исключительно после коррекции гиповолемии. У пациентов с гипотиреозом одновременно с этим проводилась коррекция дозы используемых тиреоидных гормонов и осуществлялась инфузия бета-симпатомиметических препаратов. Таким образом, для достижения необходимого уровня АДср использовался разработанный ранее алгоритм [14]. В дальнейшем, в течение всего раннего послеоперационного периода, поддерживался тот уровень АДср, при котором SjvO2 и ScvO2 были максимальными, а лактат в крови обеих вен - минимальным. По-сути, так происходила оптимизация АДср.
Определение уровней SjvO2, ScvO2, LACjv и LACcv, характерных для пациентов с опухолями ХСО и неосложненным течением раннего послеоперационного периода.
Определение уровня АДср у пациентов с развившейся в раннем послеоперационном периоде артериальной гипотензией, при котором SjvO2, ScvO2, LACjv и LACcv наиболее приближены к этим показателям у пациентов с неосложненным течением послеоперационного периода.
Сравнение исходов пациентов, имевших неосложненное течение послеоперационного периода, с исходами пациентов, имевших осложненное течение послеоперационного периода без эпизодов артериальной гипотензии, и исходов пациентов с осложненным течением послеоперационного периода и эпизодом артериальной гипотензии, но которым АДср искусственно поддерживали на уровне, при котором значения SjvO2, ScvO2, LACjv и LACcv были максимально приближены к этим значениям у пациентов с неосложненным течением послеоперационного периода.
Исходы оценивались по шкале исходов Глазго (ШИГ): 1 – летальный исход; 2 – вегетативное состояние; 3 – тяжелая инвалидизация (пациент требует постоянного ухода за ним); 4 – умеренная инвалидизация (пациент не нуждается в постороннем уходе, но он неработоспособен); 5 – хорошее восстановление (пациент работоспособен). ШИГ 1-3 считается неблагоприятным исходом, ШИГ 4-5 – благоприятным. Причины летального исхода анализировались. Учитывалась длительность пребывания пациента в отделении реанимации.
Для статистического анализа были применены методы непараметрической статистики в программе Statistica 7.0. Для оценки статистической значимости различий использовались следующие критерии: критерий Mann-Witney при сравнении показателей двух независимых групп; критерий Wilcoxon при сравнении показателей двух зависимых групп; критерий Kruskal-Wallis при сравнении показателей трех и более независимых групп; критерий Friedman с расчётом коэффициента Kendall при сравнении показателей трех зависимых групп. Все данные представлены в виде медианы, а разброс в виде верхнего и нижнего квартилей.
Анализ общих данных
В исследование вошло 30 пациентов, 14 из которых были женщины. Медиана возраста составила 47,5 лет. У 11 пациентов была аденома гипофиза, у 9 – менингиома ХСО, у 7 – краниофарингиома, у 2 – хордома ХСО и у 1 – глиома ХСО. Пациенты были разделены на три группы. Группу 1 (n=11) составили больные с неосложненным течением послеоперационного периода. Группу 2 (n=12) составили пациенты с осложненным течением послеоперационного периода, но со стабильным АД. Группу 3 (n=7) составили пациенты с осложненным течением послеоперационного периода и эпизодом артериальной гипотензии. Группы не отличались по полу, возрасту и нейрохирургической патологии.
Анализ полученных значений ScvO2
Медиана ScvO2 во всех группах была в пределах нормы. Нормальным уровнем ScvO2 в нашем исследовании считался уровень 65-80%. В отдельных работах нормальным уровнем ScvO2 считается уровень 70-80% [16]. При выборе критериев нормы для ScvO2 мы, прежде всего, руководствовались работой Pearse R. с соавт, которые показали, что исходы лечения у хирургических пациентов достоверно улучшались, если ScvO2 превышала 64,4% [12]. Другие авторы нормальным уровнем ScvO2 считают уровень 65-80% [10, 15, 18]. Таким образом, по нашему мнению, именно 65% следует считать нижней границей нормальной ScvO2, поскольку дальнейшее ее повышение не улучшает исходов, но за счет нарастания агрессивности интенсивной терапии (увеличение объема инфузии, дозы симпатомиметических препаратов) увеличивает вероятность развития таких ятрогенных осложнений, как отек легких, нарушения ритма сердца, инфаркт миокарда и т.д.
На рисунке 1 показана медиана ScvO2 для группы 1 и 2: 1.1 – 1.4 - это значения ScvO2 на 6-ой, 12-ый, 18-ый и 24-ый час первых суток как для группы 1, так и для группы 2; 2.1 – 3.4 – это значения ScvO2 в группе 2 на вторые и третьи сутки исследования (измерения каждые шесть часов).
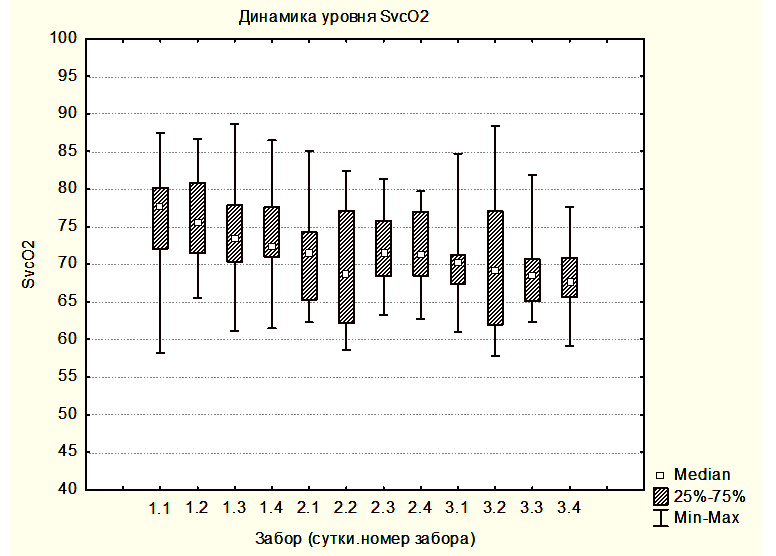
На рисунке 2 показана медиана ScvO2 для группы 3 – забор крови производился на разных уровнях АДср.
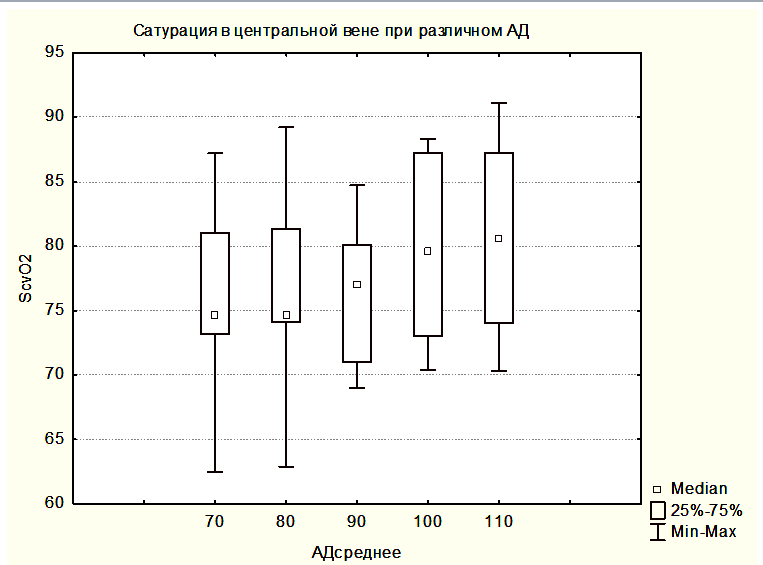
Полученный нами нормальный уровень медианы ScvO2 во всех группах свидетельствует о том, что в отличие от общехирургических пациентов, для которых ScvO2 может служить целевым критерием оптимального АД, для пациентов с опухолями ХСО в раннем послеоперационном периоде ScvO2 не может являться ориентиром для оптимизации АД. Нет предпосылок считать, что сатурация смешанной венозной крови (SvO2), измеряемая в легочной артерии при помощи катетера Свана-Ганса, была бы более пригодной в качестве критерия оптимизации АД. Это утверждение основано на данных литературы, что для популяции нейрохирургических пациентов ScvO2 и SvO2 взаимозаменяемы [7]. Как правило, ScvO2 превышает SvO2 на несколько процентов, но динамика измения этих параметров однонаправленная [13].
ScvO2 во всех измерениях была статистически достоверно выше, чем SjvO2. Эти данные показывают, что у пациентов с опухолями ХСО в раннем послеоперационном периоде при адекватном системном кровотоке может страдать мозговой кровоток. Гипотетически, учитывая то, что из исследования были исключены все пациенты, у которых развивались повреждения зон мозга, не связанных с диэнцефальной областью, можно предположить, что снижение SjvO2 свидетельствует, прежде всего, о перфузии, неадекватной метаболическим потребностям структур, находящихся именно в зоне операции. Следовательно, для оптимизации АД у пациентов после удаления опухолей ХСО следует использовать SjvO2, а не ScvO2.
Анализ полученных значений SjvO2
Нормальным уровнем SjvO2 в нашем исследовании считался уровень 60–80%. При выборе критериев нормы для SjvO2 мы руководствовались мнением Greenberg M.S. [9]. Некоторые авторы считают нормальным уровнем SjvO2 55-75% [13, 20]. Однако поддержание SjvO2 на уровне 55-59% не способно надежно предотвратить церебральную ишемию, поскольку SjvO2 50% уже является лабораторным проявлением ишемического повреждения мозга [5, 6].
Оптимизация АД у нейрореанимационных пациентов возможна при помощи мониторинга SjvO2, церебрального перфузионного давления, напряжения кислорода в веществе мозга (PbrO2), церебрального метаболизма при проведении церебрального микродиализа (МД) или при помощи транскраниальной церебральной оксиметрии. Оптимизировать АД при помощи мониторинга церебрального перфузионного давления целесообразно у пациентов, имеющих внутричерепную гипертензию, которая у больных после удаления опухолей ХСО развивается всего в 3-5% наблюдений [2]. Вследствие низкой частоты развития внутричерепной гипертензии рутинное использование мониторинга церебрального перфузионного давления у изучаемой категории пациентов не целесообразно.
Мониторинг PbrO2 и МД предполагает установку датчика непосредственно в зону предполагаемой гипоперфузии, поскольку дистальный конец датчиков этих мониторных систем не должен находиться далее 1,5 см от очага повреждения [3]. Опухоли ХСО расположены глубинно, поэтому установка датчиков PbrO2 или МД этим пациентам сопряжено с высоким риском ятрогенных интракраниальных осложнений.
Транскраниальная церебральная оксиметрия является неинвазивной методикой. Датчик крепится на кожу в проекции лобных долей и оценивает насыщение гемоглобина кислородом артериальной, венозной и капиллярной крови исключительно коры мозга [4, 11], а не диэнцефальных структур, что делает эту систему также не пригодной для оптимизации АД у пациентов с опухолями ХСО.
Таким образом, измерение SjvO2 является наиболее приемлемым и доступным для рутинного использования методом нейромониторинга, при помощи которого возможна оптимизация АД у пациентов с опухолями ХСО для достижения адекватной перфузии мозга, в том числе, и перфузии диэнцефальных структур.
В группе 1 SjvO2 была на нижней границе нормы и выше, чем у пациентов группы 2 (Рисунок 3).
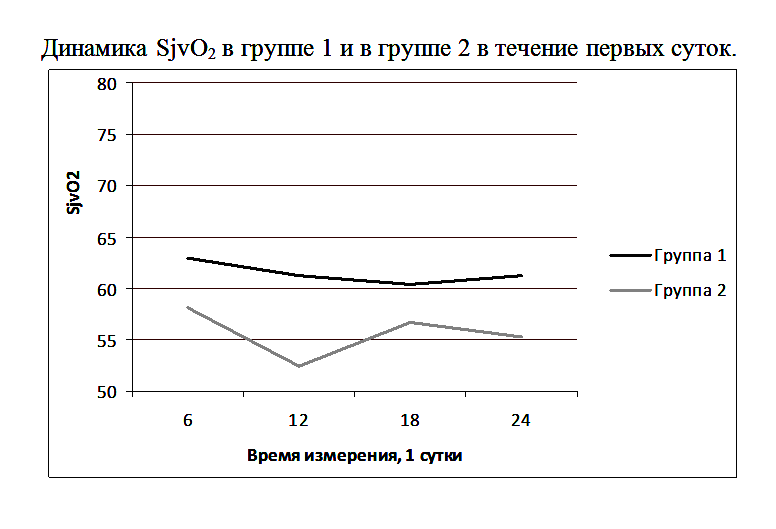
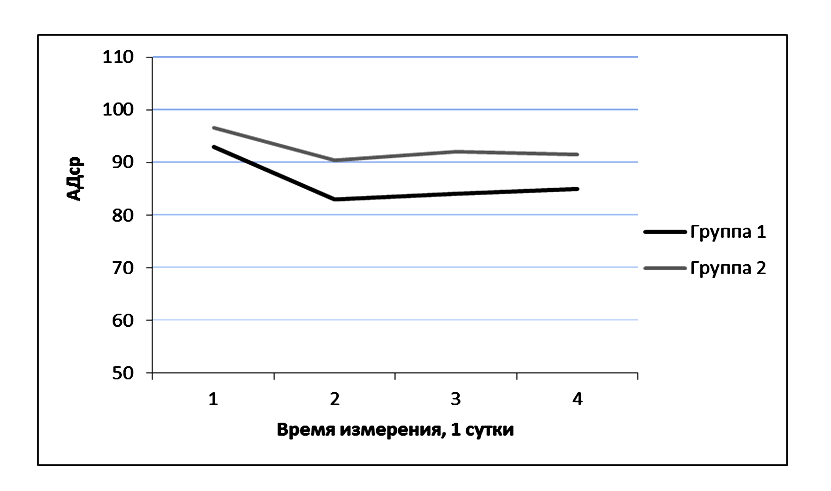
Различия в группах при первом, третьем и четвертом заборе крови (первые сутки измерения: 6, 18, 24 часа) отличались недостоверно, а при втором заборе (первые сутки измерения: 12 часов) отличия были достоверными. При этом уровень АДср был выше у пациентов второй группы: при первом, втором и третьем измерении недостоверно (первые сутки измерения: 6, 12, 18 часов), а при четвертом – достоверно (первые сутки измерения: 24 часа). (Рисунок 4).
Полученные результаты свидетельствуют о том, что при осложненном течении послеоперационного периода у пациентов с опухолями ХСО десатурация венозной крови, оттекающей от мозга, развивается даже в условиях нормального АД. Другими словами, даже при отсутствии артериальной гипотензии у этой категории пациентов увеличена экстракция мозгом кислорода, что является проявлением неадекватной перфузии и, соответственно, церебральной ишемии. Возможно, причиной неадекватной перфузии является даже не абсолютное снижение кровотока в зоне операции, а повышение метаболических потребностей структур мозга в зоне операции, при котором формально нормальные уровни перфузии оказываются неадекватными возросшим после операции метаболическим потребностям.
В группе 2 SjvO2 не достигал нормальных значений на протяжении всех трех суток ее измерения. При этом уровень АДср также не отличался между первыми, вторыми и третьими сутки. Это свидетельствует о том, что нормальный уровень АДср у изучаемой категории пациентов не гарантирует адекватного уровня SjvO2 (Рисунок 4).
В группе 3 SjvO2 было сниженным при АДср в интервале от 70 до 90 мм.рт.ст., и достоверно не отличалось от значений SjvO2 в группе 2. Однако при увеличении АДср до 100-110 мм.рт.ст. уровень SjvO2 возрастал достоверно по сравнению с исходными значениями и достигал значений SjvO2 группы 1, то есть нормальных значений (Рисунок 5).
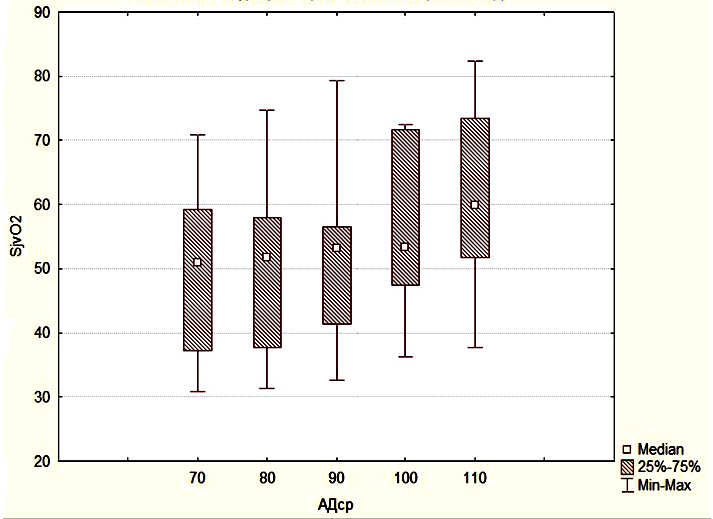
Эти данные показывают, что повышение АДср приводит к достоверному увеличению SjvO2, ее нормализации и достижения уровня, соответствующего пациентам с неосложненным течением послеоперационного периода. АДср в группе 1 было существенно ниже 100 – 110 мм.рт.ст. (Рисунок 6).
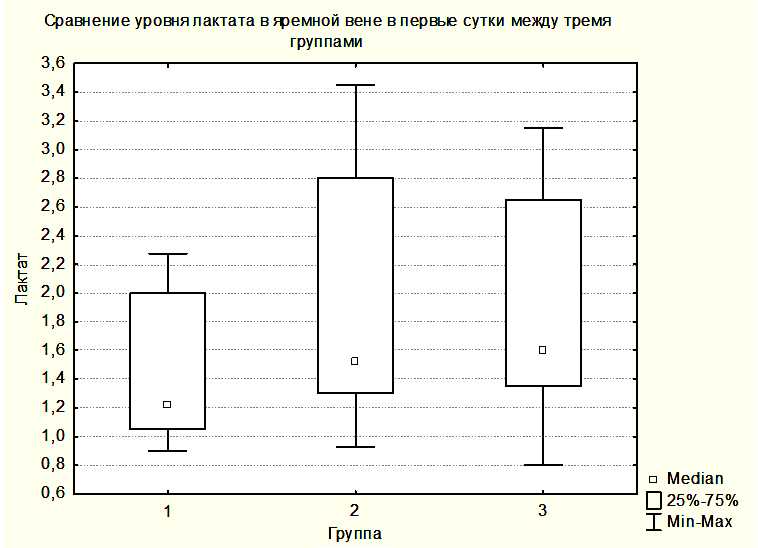
Следует подчеркнуть, что достижение и поддержание такого уровня АДср при помощи вазопрессоров не приводило к развитию каких-либо соматических осложнений, связанных с использованием препаратов этой группы. У всех пациентов группы 1 исход был благоприятным (ШИГ=4,5). Медиана длительности пребывания в ОРИТ составила 1 сутки. В группе 2 благоприятный исход был у 10 (83,3%) пациентов, 2 (16,7%) пациента умерли. В одном наблюдении причиной летального исхода было нарушение кровообращения в диэнцефальных структурах (летальный исход на 9 сутки после операции), а в другом – сепсис (летальный исход на 48 сутки после операции). Медиана длительности пребывания в ОРИТ составила 7 суток. В группе 3 благоприятный исход был у 6 (85,7%) пациентов, неблагоприятный исход – в одном (24,3%) наблюдении (ШИГ 3), летальных исходов не было. Медиана длительности пребывания в ОРИТ составила 12 суток. Несмотря на то, что состояние пациентов группы 3 было наиболее тяжелым (у них отмечались эпизоды артериальной гипотензии на фоне осложненного послеоперационного периода, и длительность пребывания в отделении реанимации была наибольшей), у них частота благоприятных исходов не отличалась от частоты благоприятных исходов в группе 2, а летальных исходов не было. Принципиальным отличием в ведении пациентов группы 2 и 3 было поддержание АДср в третьей группе на уровне 100 – 110 мм.рт.ст. Это тот уровень, при котором были получены наибольшие значения SjvO2. Из этого следует, что оптимизация АДср с учетом SjvO2 в раннем послеоперационном периоде, возможно, способна улучшить исходы у пациентов с опухолями ХСО и осложненным течением послеоперационного периода. Однако необходимы дальнейшие исследования с включением большего количества наблюдений для подтверждения этого.
Статистически достоверных закономерностей в динамике уровня лактата в крови центральной вены и в крови, оттекающей от мозга, в различных группах выявлено не было. Однако при всех измерениях уровни лактата в центральной венозной крови не отличались от уровней лактата в крови, оттекающей от мозга. Вероятно, это связано с периодом полувыведения лактата, превышающим 60 минут, а также с тем, что лактат синтезируется и разрушается как в головном мозге, так и в скелетных мышцах, печени, сердце и других органах [15]. Вместе с этим была выявлена тенденция увеличения медианы лактата как в центральной венозной крови, так и в крови, оттекающей от мозга от предыдущей группы к последующей (Рисунки 6,7). При этом медиана уровня лактата центральной венозной крови была выше медианы лактата крови, оттекающей от мозга (Рисунки 6,7), но отличия не были достоверными.
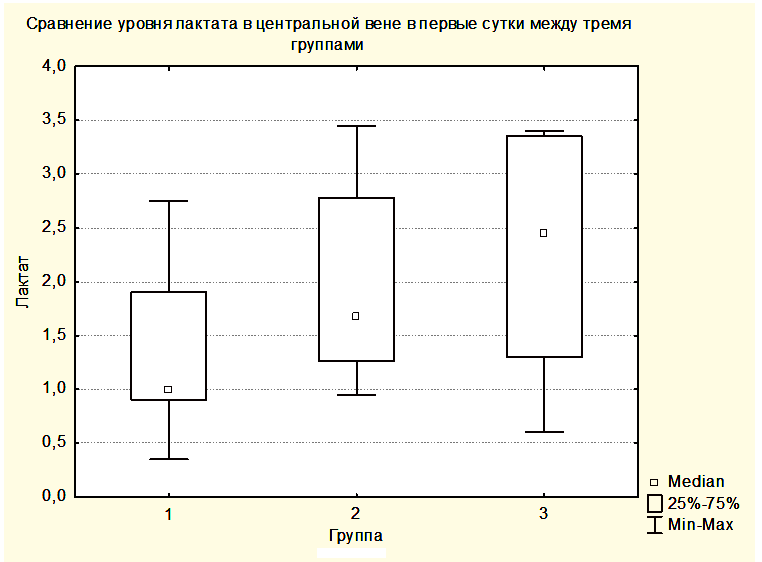
Увеличение медианы уровня лактата в группе 2 по сравнению с группой 1 и в группе 3 по сравнению с группой 2, вероятно, связано с тем, что последующие группы включили в себя более тяжелых пациентов. При повышении уровня АДср у пациентов группы 3 до уровня, приводящему к нормализации SjvO2, медиана лактата оставалась повышенной как в крови, оттекающей от мозга, так и в центральной венозной крови (Рисунки 8,9).
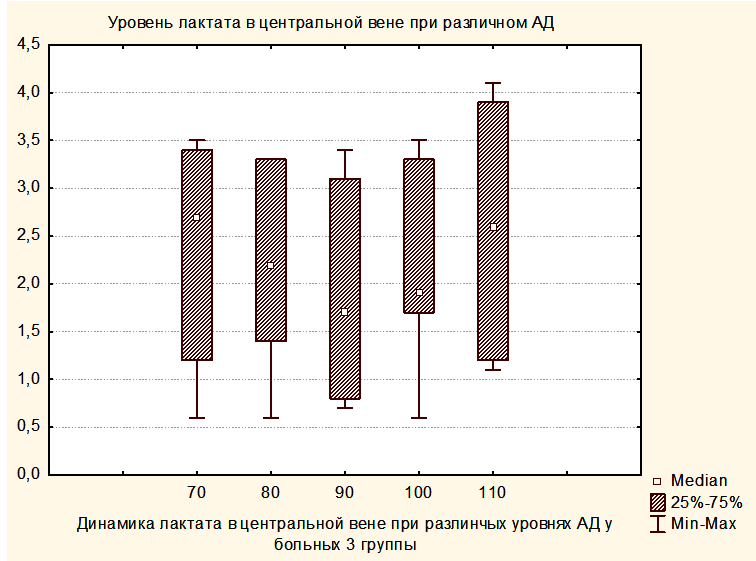
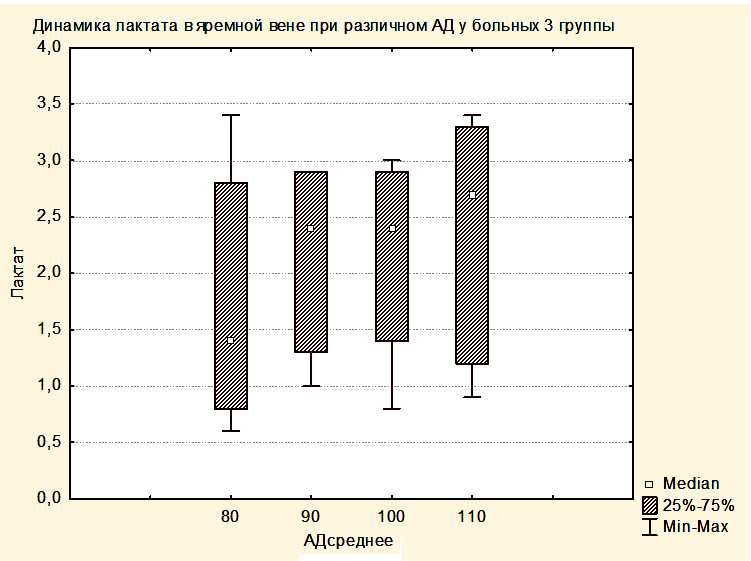
Таким образом, полученные результаты свидетельствуют о том, что уровень лактата не может использоваться в качестве критерия оптимизации АДср у пациентов с опухолями ХСО в раннем послеоперационном периоде.
1.На фоне нормального уровня артериального давления у пациентов не отмечалось снижения ScvO2 как при осложненном, так и при неосложненном течении раннего послеоперационного периода, поэтому ScvO2 не может быть критерием для оптимизации артериального давления у этой категории пациентов.
2.У пациентов с опухолями ХСО при неосложненном течении раннего послеоперационного периода SjvO2 соответствуют нижней границе нормы.
3.При осложненном течении послеоперационного периода у пациентов, у которых отсутствовал эпизод артериальной гипотензии (АДср=80-90 мм.рт.ст), выявлялись сниженные значения SjvO2, которые сохранялись на протяжении всего раннего послеоперационного периода.
4.У пациентов с опухолями ХСО, осложненным течением раннего послеоперационного периода и эпизодом артериальной гипотензии, SjvO2 достигает нормальных значений только при повышении АДср до 100 – 110 мм.рт.ст. методами интенсивной терапии. Тогда как при АДср 70, 80 и 90 мм.рт.ст. SvjO2 остается сниженной.
5.Оптимизацией АД, достигаемой повышением уровня SjvO2, можно улучшить исход у пациентов с опухолями ХСО и осложненным течением раннего послеоперационного давления. Дальнейшие исследования необходимы для подтверждения этого вывода.
6.При осложненном течении послеоперационного периода следует или поддерживать АДср на уровне 100 – 110 мм.рт.ст, или оптимизировать АДср под контролем SjvO2.
1.Аденомы гипофиза: клиника, диагностика, лечение// Под ред. Б.А. Кадашева. М.-Тверь: ООО «Издательство Триада», 2007. 368 с. 2.Попугаев К.А., Савин И.А., Горячев А.С. и соавт. Синдром диэнцефальной дисфункции.// Анестезиология и реаниматология. 2012, принята в печать. 3.Andrews P.J., Citerio G., Longhi L., et al. Neuro-Intensive Care and Emergency Medicine (NICEM), Section of the European Society of Intensive Care Medicine NICEM consensus on neurological monitoring in acute neurological disease.// Intensive Care Med. 2008:V.34, p.1362–1370. 4.Dagal A, Lam A.M. Cerebral blood flow and the injured brain: how should we monitor and manipulate it?// Curr Opin Anaesthesiol. 2011:V.24, p.131-137. 5.Dearden N.M. Jugular bulb venous oxygen saturation in the management of severe head injury.// Current Opinion in Anaesthesiology. 1991:V.4, p.279–286. 6.De Deyne C., Decruyenaere J., Colardyn F. How to interpret jugular bulb oximetry? In: Vincent J.L., ed. Yearbook of Intensive Care and Emergency Medicine. Berlin: Springer-Verlag, 1996;731–41 7.Dueck M.H., Klimek M., Appenrodt S., et al. Trends but not individual values of central venous oxygen saturation agree with mixed venous oxygen saturation during varying hemodynamic conditions.// Anesthesiology. 2005:V.103, p.249–257 8.Gennari F.J., Adrogue H.J., Galla J.H., Madias N.E. Acid-base disorders and their treatment.// 2005: Taylor and Francis Group, Boca Raton, Fl. 9.Greenberg M.S. Handbook of neurosurgery.// 7th edition. 2010, Thieme, New York. 10.Hutter A.M. Jnr, Moss A.J. Central venous oxygen saturations. Value of serial determinations in patients with acute myocardial infarction.// JAMA. 1970:V.212, p.299-303. 11.Panerai R.B. Complexity of the human cerebral circulation.// Philos Trans A Math Phys Eng Sci. 2009: V.367, p.1319-1336. 12.Pearse R., Dawson D., Fawcett J., et al. Changes in central venous saturation after major surgery, and association with outcome.// Critical Care. 2005:V.9, p.R694-R699. 13.Pinsky M.R., Payen D. Functional hemodynamic monitoring.// 2006, Springer-Verlag Berlin Heidelberg. 14.Popugaev K.A., Savin I.A., Goriachev A.S., Kadashev B.A. Hypothalamic injury as a cause of refractory hypotension after sellar region tumor surgery.// Neurocrit Care. 2008:V.8, p.366-73. 15.Rady M.Y., Rivers E.P., Martin G.B., et al. Continuous central venous oximetry and shock index in the emergency department: use in the evaluation of clinical shock.// Am J Emerg Med. 1992:V.10, p.538-541. 16.Rivers E., Nguyen B., Havstad S., et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock.// N Engl J Med. 2001:V.345, p.1368-1377. 17.Rose J.C., Mayer S.A. Optimizing blood pressure in neurological emergencies.// Neurocrit Care. 2004:V.3, p.287-300. 18.Scalea T.M., Hartnett R.W., Duncan A.O., et al. Central venous oxygen saturation: a useful clinical tool in trauma patients.// J Trauma. 1990:V.30, p.1539-1543. 19.Shoemaker W.C., Appel P., Kram H.B., et al. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients.// Chest. 1988:V.94, p.1176-1186. Torbey M.T. Neurocritical care.//2010, Cambridge University Press, Cambridge.
Полупан А.А., Горячев А.С., Савин И.А., Сатишур О.Е., Ошоров А.В., Попугаев К.А., Сычев А.А., Табасаранский Т.Ф., Крылов К.Ю., Соколова Е.Ю., Мезенцева О.Ю., Подлепич В.В., Непомнящий В.П. НИИ нейрохирургии им.акад.Н.Н.Бурденко РАМН, Москва, *Больница скорой медицинской помощи, Минск, * НИИ скорой помощи им. Н.В. Склифосовского, Москва
Р0.1– величина снижения давления в дыхательных путях в первые 100 мсек самостоятельной дыхательной попытки пациента при окклюзии дыхательного контура [4]. Этот показатель в норме у здорового человека составляет от -2 мбар до -4 мбар или -2/-4 см водного столба. У пациентов с обструктивыми или рестриктивными заболеваниями легких этот показатель выше нормы. Больному трудно вдохнуть и он вынужден прикладывать дополнительные усилия, чтобы преодолеть повышенное сопротивление дыхательных путей (при ХОБЛ) или жестких (stiff) легких (при пневмонии). Таким образом повышение Р0.1 является критерием увеличения работы дыхания пациента [8,9,10]. Современные аппараты ИВЛ оснащены системами для измерения Р0.1. В начале каждого спонтанного вдоха пациента аппарат постоянно производит измерение Р0.1 и выводит показатель на экран монитора. Если врачу удается подобрать оптимальный уровень поддержки вдохов, Р0.1 приближается к норме. Работа дыхания пациента снижается, комфортность ИВЛ увеличивается [11,12,13]. Р0.1 рутинно используется при паренхиматозной дыхательной недостаточности для оценки работы дыхания пациента и для подбора оптимального давления респираторной поддержки. Для пациентов нейрохирургической клиники после плановых операций более характерно развитие не паренхиматозной, а вентиляционной дыхательной недостаточности, когда дыхательная мускулатура не обеспечивает вдохов достаточной глубины и частоты. Иначе говоря, происходит угнетение дыхания. При интракраниальных вмешательствах к угнетению ЦНС или непосредственному повреждению ствола мозга приводят факторы хирургической агрессии (тракции мозга, электрокоагуляция, нарушение васкуляризации и т.д.) или послеоперационные осложнения (гематомы, отек мозга, дислокации, пневмоцефалия). Вариант вентиляционной дыхательной недостаточности, при котором нарушается функция дыхательного центра, описывают как нарушение респираторного драйва. Респираторный драйв – это способность дыхательного центра инициировать вдохи адекватные по частоте, глубине и ритму в соответствии с функциональной задачей. У пациентов, оперированных по поводу опухолей задней черепной ямки, необходимость в продлении ИВЛ возникает чаще, чем после удаления опухолей других локализаций. По данным Cata и соавт., 18% пациентов после операций на структурах ЗЧЯ требуют продленной ИВЛ в раннем послеоперационном периоде [1]. Анализ причин продленной ИВЛ у пациентов с осложненным течением послеоперационного периода выявил, что имеются различия в структуре показаний к пролонгированию ИВЛ при различной локализации процесса. Так, наиболее частой причиной продолжения ИВЛ у пациентов после инфратенториальных вмешательств служили бульбарные нарушения и угнетение дыхания на фоне поражения дыхательного центра, в то время как после супратенториальных вмешательств основными показаниями к проведению продленной ИВЛ служили глубокое угнетение сознания или необходимость седации в связи с судорогами или психомоторным возбуждением [2]. Поражение дыхательного центра клинически проявляется нарушением дыхания в виде апноэ или брадипноэ, а также в виде снижения силы дыхательных попыток пациента. У таких пациентов величина Р0.1 ниже нормы. Традиционные критерии готовности к отлучению от респиратора, такие как показатель «частого поверхностного дыхания», или индекс Тобина, или максимальное усилие вдоха, не учитывают состояние респираторного драйва, в связи с чем у пациентов с поражением ствола головного мозга они часто оказываются неэффективными [3]. Дополнительный риск для пациентов с поврежденным стволом мозга создает повышенная утомляемость дыхательного центра. Вследствие утомления после периода вполне адекватного дыхания может возникнуть брадипноэ со снижением дыхательного объема (редкое поверхностное дыхание). Из используемых в настоящее время критериев, характеризующих респираторный драйв наиболее доступным для прикроватного измерения является показатель Р0.1. Логично ожидать, что у пациентов с угнетением или повреждением дыхательного центра Р0.1 будет снижен, однако публикаций по этой прблеме мало. При проведении поиска литературы в PubMed мы нашли только одну работу, посвященную оценке показателя Р0.1, у пациентов с повреждением ствола головного мозга и поражением дыхательного центра [7].
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Первые отделения интенсивной терапии (ОИТ), где использовалась длительная ИВЛ для спасения жизни пациентов и лечения заболевания, были созданы в Европе в 1952 во время эпидемии полиомиелита. По существу первые ОИТ были отделениями нейроинтенсивной терапии для лечения пациентов с повреждением ЦНС. В настоящее время в мире по данным исследовательской группы профессора Pelosi среди пациентов ОИТ не менее 20% находится на ИВЛ по неврологическим показаниям [1]. Пациенты неврологических и нейрохирургических клиник, нуждающиеся в ИВЛ, имеют важное отличие от пациентов ОИТ общего профиля. Показанием для проведения ИВЛ в нейро-ОИТ является не заболевание легких рестриктивного или обструктивного типа, а нарушение работы дыхательного центра вследствие прямого или опосредованного повреждения ствола мозга или нарушение нервно-мышечной проводимости, приводящее к слабости дыхательной мускулатуры. Эта специфика показаний для ИВЛ обуславливает особенности выбора режимов ИВЛ и стратегии прекращения респираторной поддержки. В настоящей работе представлен годовой анализ использования продолжительной ИВЛ в лечении пациентов в отделении реанимации НИИ нейрохирургии им академика Н.Н. Бурденко РАМН за 2010 год.
Исследование носило ретроспективный характер и было основано на анализе историй болезни пациентов, находившихся на лечении в отделении реанимации с января 2010 по декабрь 2010 г включительно. Критерием включения являлась продолжительность ИВЛ свыше 48 часов. Анализировалась длительность ИВЛ, показания к пролонгированию ИВЛ у разных категорий больных, сроки экстубации, сроки трахеостомии, частота развития вентилятор-ассоциированной пневмонии. Согласно критериям включения, для анализа была отобрана 131 история болезни. Среди включенных в исследование пациентов было 77 мужчин и 54 женщины в возрасте от 2 месяцев до 81 года (средний возраст составил 34,5±19,6 лет). Среди пациентов, потребовавших проведения пролонгированной ИВЛ, было 64 пациента с нейроонкологией, 29 пациентов с ЧМТ, 21 пациент с САК, 6 пациентов с геморрагическим инсультом, 4 пациента с ишемическим инсультом, 2 пациента со спинальной патологией и 5 пациентов с иными нозологиями. В таблице 1 представлено разделение пациентов, нуждавшихся в пролонгированной ИВЛ, по нозологии.
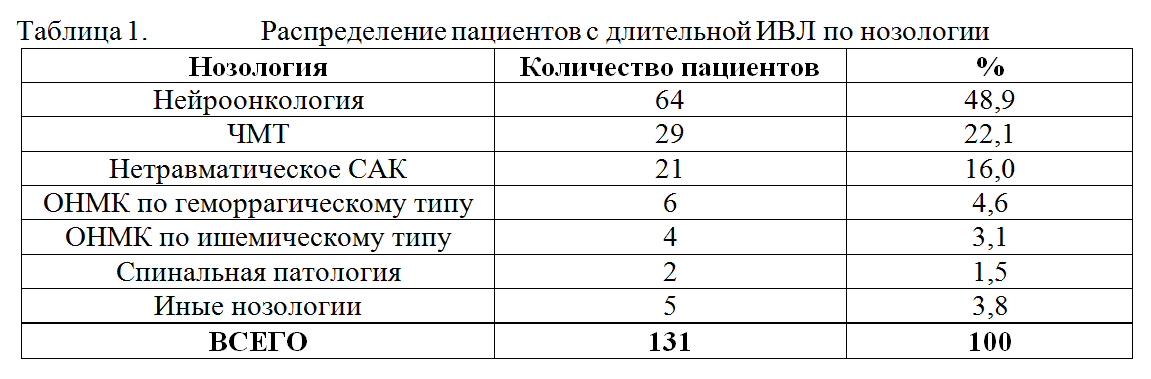
У 89 (67,9%) пациентов, получавших пролонгированную ИВЛ, была выполнена пункционная дилятационная трахеостомия. Показаниями для выполнения трахеостомии были: Ожидаемая длительная ИВЛ (>7 cуток); Грубые нарушения глотания [2]; Удаление опухоли трансоральным доступом. Всем взрослым пациентам пункционно-дилятационная трахеостомия (ПДТ) выполнялась по модификации, разработанной в Институте [3,4,5]. Во всех сложных случаях (короткая, толстая шея, положение без валика под плечами или иное нарушение анатомических ориентиров) на этапе пункции трахеи выполняется фиброскопический контроль.
Уход за трахеостомой. Кожа вокруг трахеостомы обрабатывалась раствором «Октенисепт», затем на область вокруг стомы накладывалась мазь «Бетадин» на основе повидон-йода и стерильные салфетки. Перевязки выполнялись 2 раза в сутки, а в случае пропитывания салфеток отделяемым из стомы - чаще. Использовался условный критерий «вокруг трахеостомы всегда чистая, сухая салфетка». Санация носовых ходов выполнялась минимум 3-4 раза в сутки с использованием тонкого мягкого санационного катетера. После санации в носовые ходы впрыскивалась аэрозоль «Биопарокс». При обильном отделении слизи из носовых ходов, аспирация слизи производилась чаще, дополнительно использовались препараты на основе ксилометазолина («Нафтизин», «Галазолин»). В 9 случаях, при выявлении синуситов выполнялись лечебные пункции гайморовых пазух с отмыванием содержимого раствором «мирамистин» и последующим введением антибиотиков.
Полость рта и зубы обрабатывались с использованием раствора и аэрозоля «Гексорал» два раза в сутки или чаще. Для механического удаления густой слизи и налётов использовались палочки с ватными тампонами на конце. Часть трахеостомированных пациентов на ИВЛ получала пероральное кормление. В этом случае рот обрабатывали после каждого кормления, начиная с полоскания рта чистой водой. Для ротоглотки использовались гибкие мягкие санационные катетеры и твердые пластиковые изогнутой формы. Санация трахеи выполнялась с использованием гибких одноразовых стерильных катетеров. После однократного использования катетер выбрасывался. При наличии избыточного количества мокроты гнойного характера при санации использовался 0,1% раствор диоксидина, ex-temporo приготовленный на физиологическом растворе. При санационных фибробронхоскопиях использовался такой же раствор. У всех трахеостомированных пациентов были использованы трахеостомические трубки с каналом для санации надманжеточного пространства и особо мягкой герметизирующей манжетой – трубки фирмы «Portex» серии «Blue line Ultra Soft Seal». Использование таких трубок позволяло эффективно удалять из трахеи секрет, скапливающийся выше герметизирующей манжеты, и промывать верхние отделы трахеи и гортань.
Искусственная вентиляция легких проводилась с использованием аппаратов Puritan Bennet 7200, Hamilton G5, Hamilton Raphael, Puritan Bennet 840. В качестве стартовых режимов ИВЛ мы использовали режимы SIMV, управляемые по объему или по давлению (272 пациента), режим ASV (33 пациента) и режим DuoPAP (10 пациентов).
В качестве стартового режима SIMV использовался в 272 случаях. Дыхательный объем составлял 8-10мл/кг. Исходная частота дыханий составляла 10-12 в мин. Поддержка давлением составляла 12-16 мбар. При появлении самостоятельных дыхательных попыток частота дыхания аппаратных вдохов уменьшалась, а уровень поддержки давлением подбирался с целью обеспечения нормовентиляции (минутный объем 100 мл/кг/мин, РаCO2 35-40 мм рт.ст.). При развитии бради- или тахипноэ наращивалась частота принудительных вдохов. Отлучение пациентов от респиратора проводилось либо путем постепенного уменьшения числа принудительных вдохов в режиме SIMV, либо путем перевода в режим Pressure Support с постепенным снижением уровня поддержки давлением, либо путем перевода в режим ASV.
Режим ASV использовался в качестве стартового у 33 пациентов. Исходный процент замещения минутного объема составлял 100% и в дальнейшем корригировался под контролем PaCO2. В большинстве случаев режим ASV хорошо переносился пациентами, и вентиляция в этом режиме осуществлялась в течение всего периода респираторной поддержки вплоть до отключения от респиратора. В ряде случаев, ввиду развития выраженной гипервентиляции при осуществлении ИВЛ в режиме ASV, приходилось переходить на другие режимы.
Режим DuoPAP использовался у 10 пациентов, у которых течение основного заболевания осложнялось развитием острого повреждения легких или острого респираторного дистресс синдрома. В этих случаях во избежание баро- и ателектотравмы легких с использованием построения квазистатической петли давление-объем (инструмент PV-tool на аппаратах Hamilton G5) определялись нижняя и верхняя точка перегиба. В дальнейшем ИВЛ осуществлялась в режиме DuoPAP с выставлением нижнего давления на уровне на 2 мбар выше нижней точки перегиба, а верхнего уровня давления на уровне на 2 мбар ниже верхней точки перегиба (рисунок 3).
У всех пациентов, находившихся на ИВЛ более суток, для увлажнения дыхательной смеси использовались увлажнители – обогреватели Fisher&Pyker, где в дополнение к емкости испарителя в шлангах проложен нагревающий провод. Благодаря системе автоматического поддержания температуры, получающей информацию из трех точек дыхательного контура, удаётся добиться оптимального увлажнения и согревания дыхательной смеси и избежать выпадения конденсата в дыхательном контуре. Для оценки качества увлажнения использовалась шкала оценки вязкости бронхиального секрета [9]. Жидкий – после аспирации мокроты санационный катетер чист. Умеренно вязкий – после аспирации мокроты санационный катетер сразу очищается при промывании водой. Вязкий – после аспирации мокроты санационный катетер трудно отмыть от мокроты. Во всех наблюдениях консистенция мокроты у пациентов на ИВЛ была жидкой. При анализе данных использовались методы описательной статистики. Данные представлены, как среднее ± стандартное отклонение.
Средняя длительность ИВЛ составила 20,8±24,5 суток. На рисунке 1 и в таблице 2 представлено распределение пациентов по длительности ИВЛ.
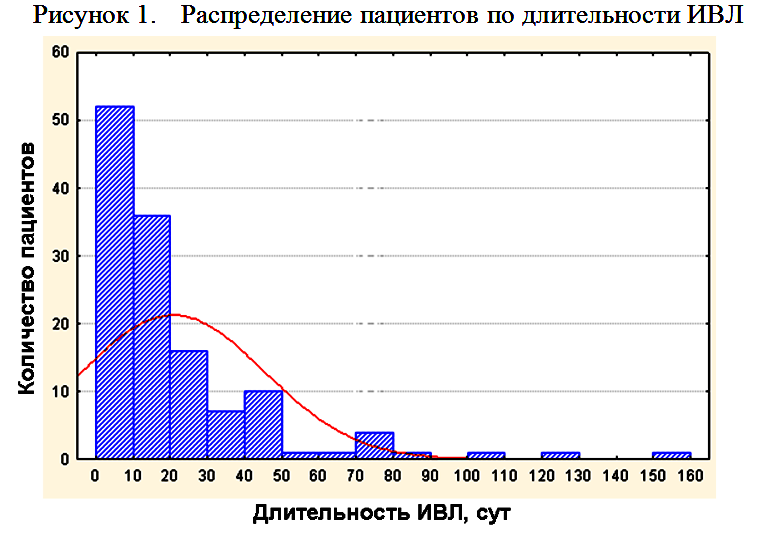

Причинами проведения пролонгированной ИВЛ служило угнетение сознания в 81 (61,8%) случаев, необходимость седации в 21 (16,8%) случаев (из них в 7 (5,3%) случаях в связи с судорогами, в 15(11,5%) случаях в связи с психо-моторным возбуждением), угнетение респираторного драйва в 17 (13%) случаев, паренхиматозная дыхательная недостаточность в 11 (8,4%) случаев (рисунок 2).
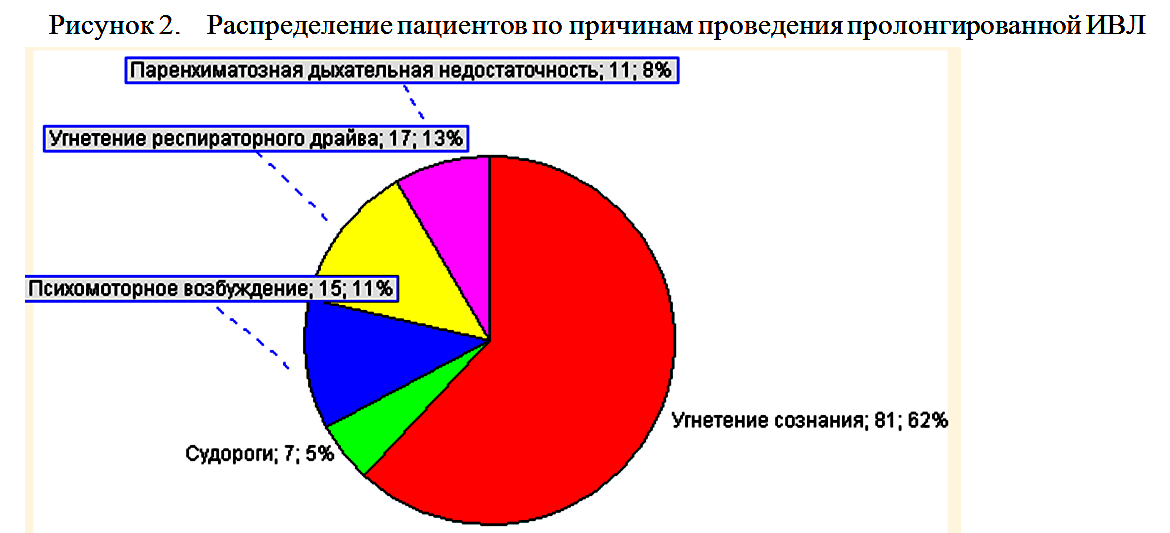
Средняя длительность ИВЛ у пациентов с ЧМТ составила 21,4±24 суток. В группе пациентов с ЧМТ наиболее частой причиной проведения ИВЛ было угнетение сознания (25 из 29 пациентов, 86,2%). У остальных 4 пациентов ИВЛ была пролонгирована в связи с необходимостью седации. ИВЛ при ЧМТ проводилась при уровне сознания 9 баллов по ШКГ и ниже. Обязательными компонентами мультимодального мониторинга у пациентов с ЧМТ, находящихся в коматозном состоянии, являлись мониторинг внутричерепного давления и капнография. Минутный объем вентиляции подбирался с целью достижения умеренной гипервентиляции (PaCO2 32-35 mmHg). В ряде случаев (11 пациентов), при устойчивой внутричерепной гипертензии минутный объем вентиляции увеличивался до достижения глубокой гипервентиляции (PaCO2=28-30 mmHg). Фракция кислорода во вдыхаемой смеси подбиралась под контролем газового состава артериальной крови для поддержания PaO2 90-100 мм рт.ст. Средняя FiO2 в остром периоде ЧМТ составляла 34,8±10,8 %. У пациентов с ЧМТ чаще чем у пациентов с другой нозологией отмечалось развитие ОПЛ и ОРДС. Диагноз ОПЛ выставлялся при наличии двусторонней инфильтрации легких на рентгенограмме и снижении индекса PO2/FiO2<300. Диагноз ОРДС выставлялся при наличии двусторонней инфильтрации легких на рентгенограмме и снижении индекса PO2/FiO2 менее 200. Согласно этим критериям диагноз ОРДС был выставлен у 4 пациентов с ЧМТ, диагноз ОПЛ у 12 пациентов с ЧМТ. При развитии ОРДС или ОПЛ с целью проведения расширенного респираторного мониторинга и оптимизации ИВЛ пациенты переводились на ИВЛ аппаратом Hamilton G5 в режиме DuoPAP. Для выбора оптимальных уровней нижнего и верхнего значений PEEP выполнялось построение квазистатической кривой давление-объем с использованием приема PV-tool. Суть маневра заключается в последовательном построении инспираторной и экспираторной кривой давление-объем. Маневр состоит из следующих фаз: Продленный выдох. Фаза выдоха продлевается до снижения давления до заданного Pstart. Линейное повышение давления. Давление в дыхательных путях постепенно повышается с постоянной скоростью Ramp speed до уровня Ptop. При этом фикисируется достигнутый объем. Пауза. Давление в дыхательных путях поддерживается на уровне Ptop в течение времени Tpause. Линейное снижение давления. Давление с постоянной скоростью Ramp снижается до уровня End PEEP. Установка нового PEEP. Аппарат предлагает установить новый уровень PEEP равный End PEEP.
При построении квазистатической кривой давление-объем для определения верхней и нижней точек перегиба и гистерезиса мы устанавливали Pstart=0 мбар, Ptop=60 мбар, Tpause=5 сек, PEEPend=10 мбар. На полученной квазистатической кривой давление- объем мы определяли нижнюю и верхнюю точки перегиба и гистерезис т.е. разницу объемов на экспираторной и инспираторной кривых при давлении, соответствующем нижней точке перегиба (рисунок 3).
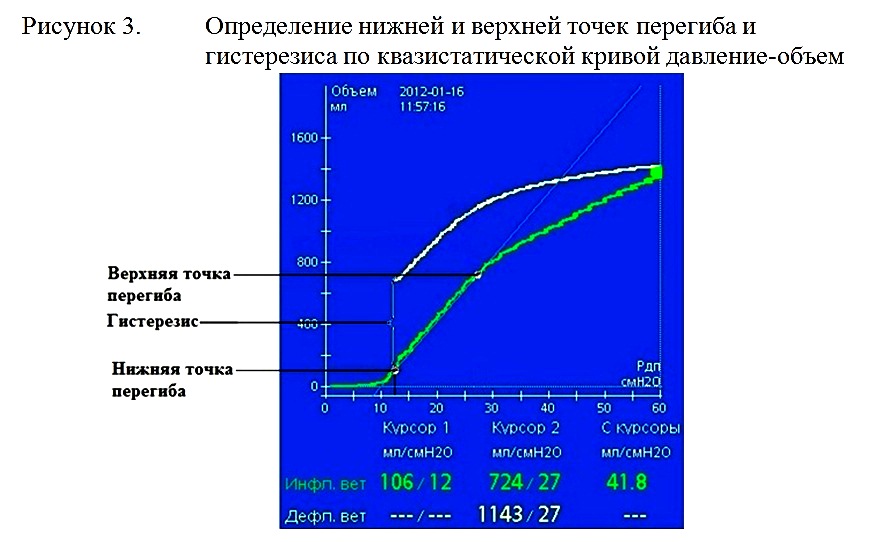
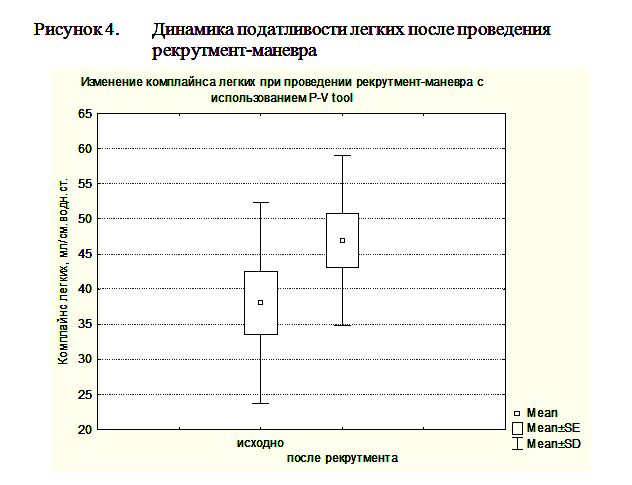
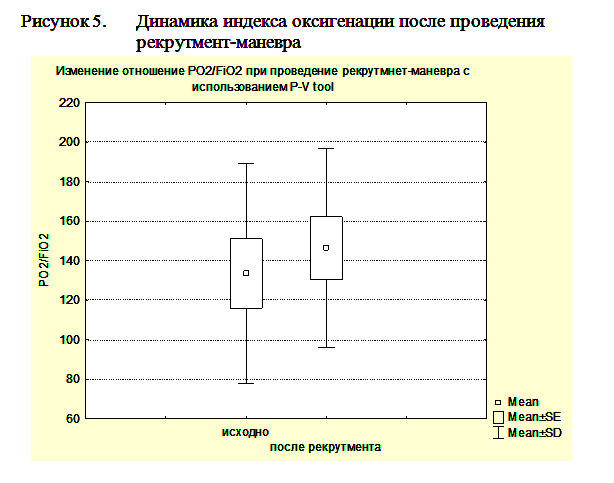
Гистерезис более 300мл мы расценивали, как предиктор эффективности рекрутмент-маневра. Рекрутмент-маневр в этих случаях выполнялся с помощью повторного маневра PVtool. При этом мы увеличивали PEEPend до значения на 2 мбар выше нижней точки перегиба, Tpause до 10сек, а остальные параметры оставляли без изменений. При гистерезисе менее 300мл рекрутмент-маневр не проводился. После выполнения маневра PVtool и, при необходимости, рекрутмент-маневра ИВЛ продолжали в режиме DuoPAP, устанавливая уровень PEEPlow на 2мбар выше нижней точки перегиба, а PEEPhigh на уровне на 2 мбар ниже верхней точки перегиба. Всего рекрутмент маневр был выполнен у 8 пациентов с ЧМТ. Проведение рекрутмент-маневра приводило к возрастанию индексу оксигенации (PO2/FiO2) с 128,9±47,4 по 148,2±55,5 и повышению комплайнса легких с 38,1±14,3 мл/мбар до 49,9±12,1 мл/мбар при ОРДС и ОПЛ (рисунки 4, 5).
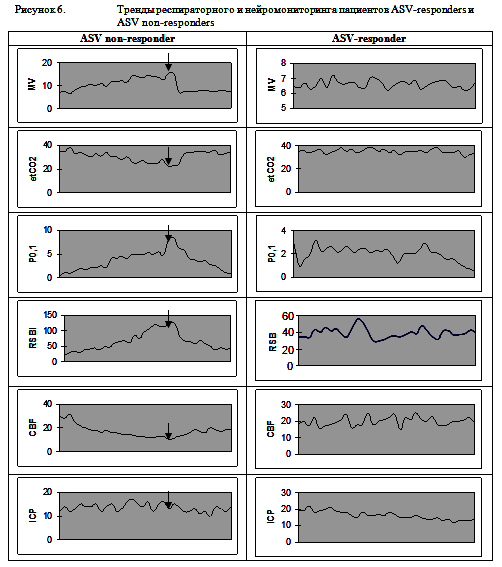
У 10 пациентов с ЧМТ мы с первых суток ИВЛ использовали режим ASV. Предположительными преимуществами режима ASV у пациентов с ЧМТ перед принудительными режимами вентиляции являются обеспечение заданного оператором минутного объема вентиляции вне зависимости от самостоятельной дыхательной активности пациента и подбор параметров вентиляции (частоты дыхания, инспираторного давления) оптимальных для защиты легких конкретного пациента, с учетом индивидуальных особенностей респираторной механики пациента. Из 10 пациентов с ЧМТ, у которых с первых суток использовался режим ASV, в 7 случаях этот режим хорошо переносился пациентами и использовался до момента отключения от респиратора. При этом отмечалось постепенное нарастание доли спонтанных вдохов и снижение подбираемого респиратором инспираторного давления. У 3 пациентов при использовании режима ASV развивалась гипервентиляция, сопровождающаяся выраженным снижением уровня PCO2 и снижением регионарного мозгового кровотока, а также нарастание уровня Р0,1. В связи с плохой переносимостью режима ASV у этих пациентов выполнялась смена режима вентиляции на SIMV. Вероятно, развитие гипервентиляции у этой группы пациентов было обусловлено ирритацией стволовых структур за счет дислокации головного мозга. Перевод в принудительные режимы вентиляции позволял добиться нормовентиляции, нормализации EtCO2 и регионарного церебрального кровотока и снижения P0,1. Примеры трендов респираторного и нейромониторинга пациентов, хорошо переносивших режим ASV (ASV-responders), и потребовавших перевода в режим SIMV (ASV non-responders) представлены на рисунке 6.
Таким образом, в большинстве случаев режим ASV хорошо переносился пациентами с черепно-мозговой травмой и позволял осуществлять респираторную поддержку с первых суток вентиляции до момента отлучения от респиратора. Использование режима ASV позволяло, во-первых, максимально сохранить спонтанную дыхательную активность без риска развития гиповентиляции, во-вторых, проводить протективную вентиляцию с непрерывной коррекцией подбираемого аппаратом инспираторного давления, минимизируя тем самым вероятность развития вентилятор индуцированного повреждения легких.
По локализации новообразования пациенты с нейроонкологией, потребовавшие проведения длительной ИВЛ, были распределены на 6 групп, как представлено на рисунке 7.
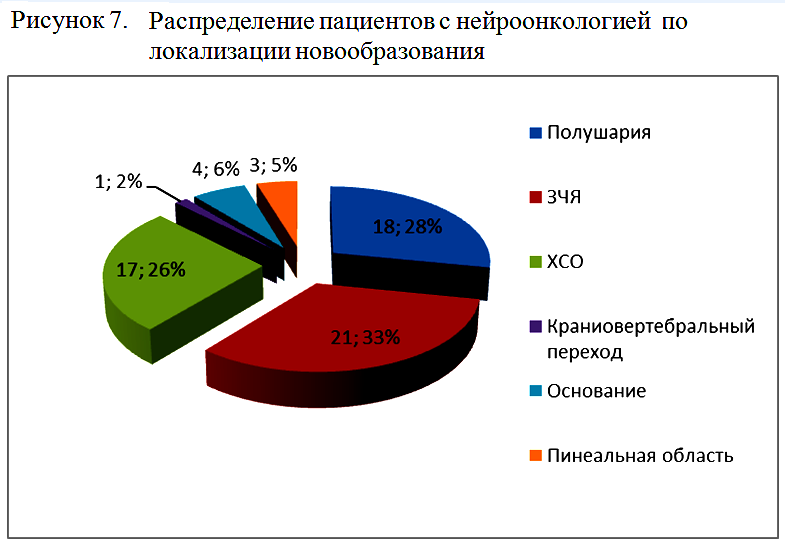
Средняя длительность ИВЛ у пациентов с нейроонкологией составила 18,4±21,3 суток. При этом отмечалась разнородность в длительности и в структуре показаний к продленной ИВЛ в зависимости от локализации новообразования.
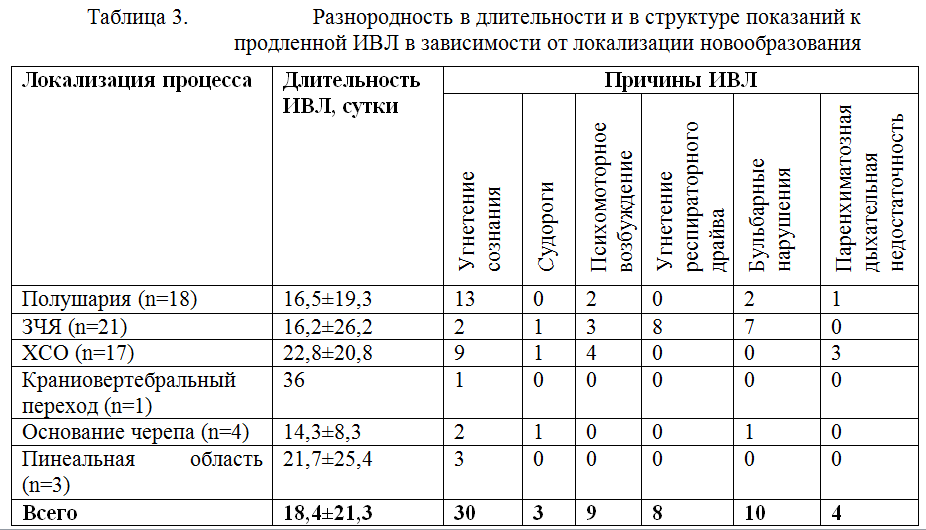
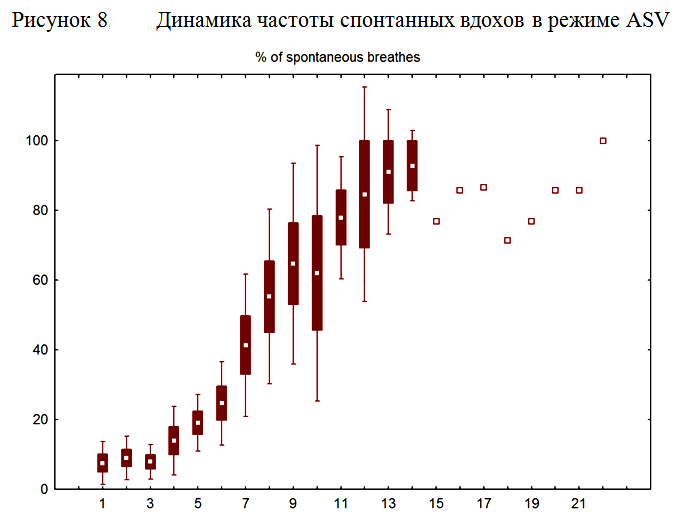
Как видно из таблицы 3, среди пациентов с локализацией процесса в полушариях основным показанием к продленной ИВЛ было угнетение сознания. Среди пациентов, оперированных на задней черепной ямке, основным показанием к пролонгированию ИВЛ служила стволовая дисфункция в виде угнетения респираторного драйва, либо в виде бульбарных нарушений. Хотя бульбарные нарушения не являются показанием к искусственной вентиляции легких, а требует исключительно защиты дыхательных путей путем их протезирования, в ряде случаев наличие грубого бульбарного синдрома служило причиной пролонгированной ИВЛ. Так у 7 пациентов, оперированных по поводу опухолей задней черепной ямки, у которых в раннем послеоперационном периоде было восстановлено ясное сознание, прошедших тест спонтанного дыхания (Spontaneous breathing trial), искусственная вентиляция легких была пролонгирована в связи с грубыми нарушениями глотания. Средняя длительность ИВЛ у этой подгруппы пациентов составила 5,3±2,6 суток. Из 7 пациентов с бульбарным синдромом 2 пациента были успешно экстубированы на 3-5 день после операции. У 5 пациентов попытка экстубации оказалась неуспешной, и для защиты дыхательных путей от аспирации была выполнена трахеостомия, после чего ИВЛ была прекращена. Поражение стволовых структур может сопровождаться развитием дыхательной недостаточности центрального генеза вследствие угнетения респираторного драйва и развития поверхностного дыхания со сниженной частотой, вплоть до апноэ. При проведении ИВЛ у данной группы пациентов является опасным преждевременное снижение степени респираторной поддержки вследствие недооценки тяжести поражения ствола головного мозга на фоне высокого уровня бодрствования и выявления критериев готовности к отлучению от респиратора. Преждевременный перевод во вспомогательные режимы ИВЛ на фоне недостаточного восстановления дыхательного драйва может приводить к нарушениям дыхания по стволовому типу, эпизодам апноэ и брадипноэ. Возникающие нарушения дыхания могут усугублять гипоксию в пораженной области ствола головного мозга и еще в большей степени усугублять стволовую дисфункцию и угнетение респираторного драйва, а это требует повторного перевода больного в принудительные режимы ИВЛ. У пациентов с угнетением респираторного драйва мы использовали режим ASV. Преимуществом режима ASV у данной категории больных является непрерывная коррекция респиратором частоты принудительных вдохов и уровня давления поддержки в зависимости от спонтанной дыхательной активности пациента, которая при поражении респираторного драйва может существенно варьировать в течение суток. Исходно спонтанная дыхательная активность у данной группы пациентов была существенно снижена, и целевой минутный объем доставлялся преимущественно за счет принудительных вдохов. В первые сутки вентиляции в режиме ASV процент спонтанных вдохов составил 9,0±6,2. На протяжении вентиляции в режиме ASV отмечалось постепенное нарастание частоты спонтанных вдохов (рисунок 8). К моменту прекращения респираторной поддержки у всех пациентов 100% вдохов были инициированы пациентом.
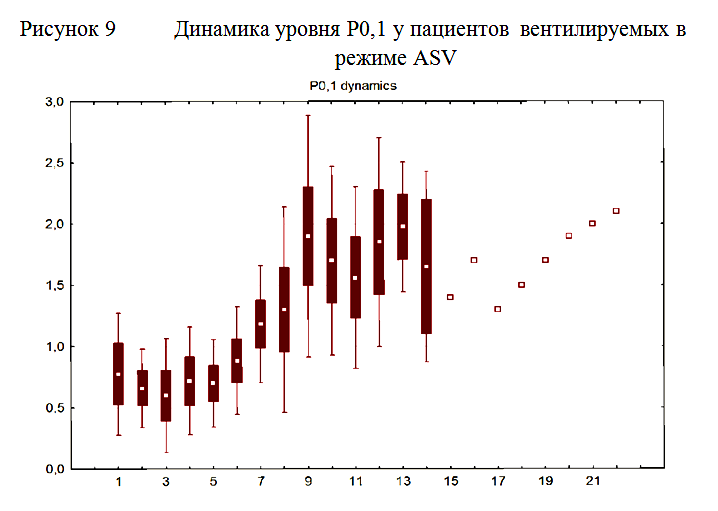
У всех пациентов исходно уровень показателя P0,1, отражающего активность дыхательного центра, был значительно ниже нормальных значений и составлял 0,78±0,5. По мере нарастания спонтанной дыхательной активности отмечалось нарастание показателя P0,1, который со временем достигал нормальных значений. К моменту прекращения ИВЛ средний уровень P0,1 составлял 2,5±0,3 (рисунок 9).
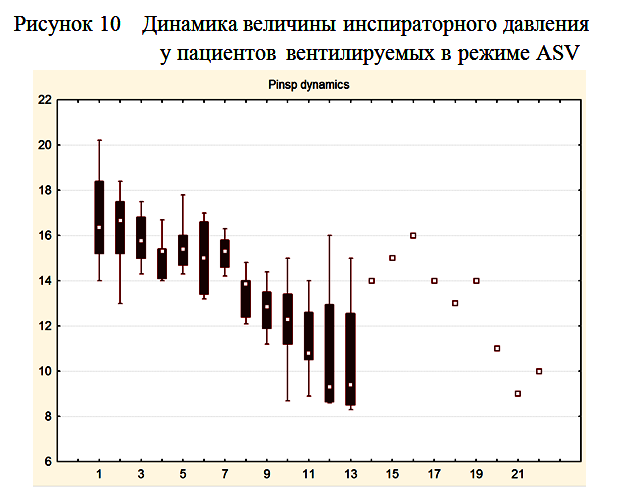
По мере нарастания спонтанной дыхательной активности отмечалось постепенное снижение инспираторного давления, подбираемого респиратором для достижения целевого дыхательного объема. К моменту прекращения респираторной поддержки инспираторное давление у всех пациентов не превышало 10 мбар (рисунок 10).
Диагноз вентилятор-ассоциированной пневмонии выставлялся при наличии инфильтративных изменений на рентгенограмме легких и наличии, как минимум, двух из четырех следующих критериев: температура тела больше 38,0ºС или меньше 36,0ºС; наличие гнойной мокроты; лейкоцитоз больше 11 тыс/мл или лейкопения менее 4 тыс/мл; PaO2/FiO2<300. При двух из четырех перечисленных критериев и отсутствии инфильтративных изменений на рентгенограмме выставлялся диагноз трахеобронхит. Общая частота развития инфекций дыхательных путей составила 41,2% (54 из 131 пациентов). Из них в соответствии с данными рентгенограммы диагноз пневмония был поставлен в 29 случаях (22,1%), а диагноз гнойный трахеобронхит в 25 случаях (19,1%). У пациентов с ЧМТ частота развития инфекций дыхательных путей была значительно выше, чем у пациентов после плановых нейрохирургических вмешательств (таблица 4).
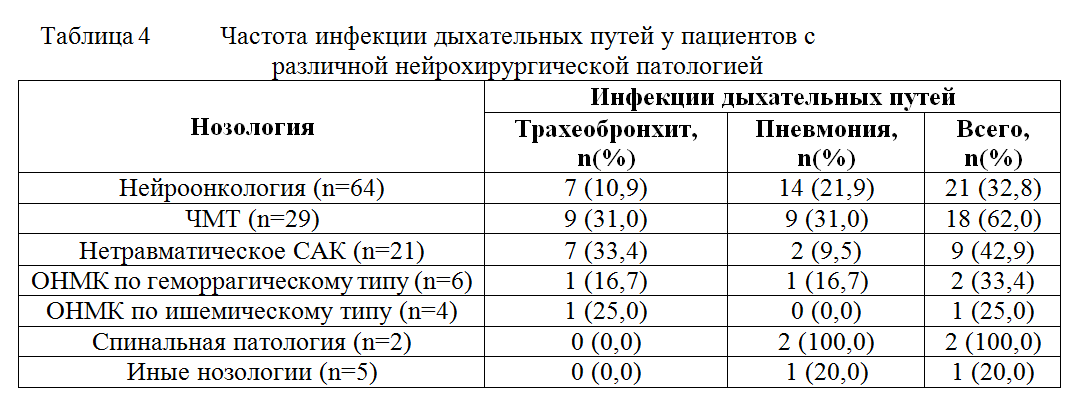
Более высокая частота развития ВАП у пациентов с ЧМТ обусловлена, по-видимому, высоким риском аспирации на догоспитальном этапе, высокой частотой развития синуситов. Развитие вентилятор ассоциированной пневмонии сопровождалось увеличением длительности нахождения на ИВЛ, в то время как развитие гнойного трахеобронхита не приводило к значимому приросту длительности ИВЛ по сравнению с пациентами без инфекции дыхательных путей. Таким образом, в ходе нашего исследования было показано, что имеется специфика респираторных проблем у различных категорий нейрохирургических пациентов. Так, у пациентов с ЧМТ чаще чем у пациентов с иной нейрохирургической патологией отмечается развитие острого повреждения легких и острого респираторного дистресс синдрома. Частое развитие ОРДС при ЧМТ может быть обусловлено несколькими факторами. Согласно концепции «двойного удара», острое повреждение мозга может приводить к повреждению легких за счет двух основных механизмов [6]. Во-первых, поврежденный мозг является источником провоспалительных цитокинов, и тригерром к развитию системного воспалительного ответа [7-10]. Было показано, что у пациентов с изолированной ЧМТ отмечается повышение таких медиаторов воспаления как IL-1, IL-6, TNF и др. В работе McKeating и соавт. сравнивалась концентрация IL-6 и в артериальной крови и в крови оттекающей от головного мозга, забранной из луковицы яремной вены [9]. Было показано, что в оттекающей от мозга крови концентрация провоспалительных цитокинов существенно превышает таковую в артериальной крови, что свидетельствует о том, что источником провоспалительных цитокинов у пациентов с ЧМТ служит именно поврежденный мозг. Развивающаяся системная воспалительная реакция приводит к повышению проницаемости легочных капилляров, миграции нейтрофилов и активированных макрофагов в альвеолярное пространство, повреждению пневмоцитов 2 типа и, как следствие, к развитию ОПЛ и ОРДС (первый удар). Вторым значимым фактором является необходимость применения агрессивной ИВЛ для обеспечения гипервентиляции для контроля внутричерепного давления. Использование для обеспечения гипервентиляции высоких дыхательных объемов способствуют развитию вентилятор-ассоциированного повреждения легких (второй удар) [11-12]. Среди пациентов с повреждением стволовых структур вследствие операций по поводу опухолей задней черепной ямки частым респираторным осложнением являлось угнетение респираторного драйва, обуславливающие трудный вининг в данной категории больных. В ходе нашего исследования было показано, что традиционные критерии готовности пациента к отлучению от респиратора, не учитывающие состояние респираторного драйва, в ряде случаев оказываются неэффективными. Нами была продемонстрирована эффективность использования показателя Р0,1 как предиктора готовности к прекращению респираторной поддержки. У пациентов с дыхательной недостаточностью, обусловленной причинами, не связанными с угнетением респираторного драйва, показатель P0,1, как правило, повышен, и степень его повышения является предиктором неэффективности отлучения от респиратора [13-15]. В нашем исследовании у пациентов с повреждением стволовых структур головного мозга наблюдается обратная закономерность и предиктором неэффективности отлучения от респиратора является снижение показателя P0,1 ниже средней нормы. Это согласуется с данными, полученными Yao-Kuang Wu и соавторами, которые показали, что у пациентов, оперированных по поводу опухолей ствола головного мозга, у которых было произведено успешное отлучение от респиратора, показатель P0,1 был значительно выше, чем у пациентов, у которых попытки прекращения респираторной поддержки оказались неэффективными, и потребовалось проведение продленной ИВЛ [16]. В этой же работе было показано, что дополнительным предиктором неэффективности отлучения от респиратора является отсутствие значимого прироста показателя P0,1 в ответ на гиперкапнию. Также было показано, что использование интеллектуального режима ASV, обеспечивающего заданный оператором минутный объем вне зависимости от самостоятельной дыхательной активности пациента с одной стороны, и максимально сохраняющего спонтанную дыхательную активность с другой стороны, позволяют сократить сроки ИВЛ у пациентов с повреждением ствола головного мозга.