Скачать статью.pdf
НИИ Нейрохирургии имени Н.Н. Бурденко, РАМН, Москва.
Введение.
Нарушение сознания у пациента, находящегося в критическом состоянии, встречается весьма часто в клинике любого профиля. Классическое описание двух фаз травматического шока, выполненное Н.И. Пироговым в середине XIX века, не утратило своей актуальности. Значительная часть этого описания касается психического состояния пациента. В первой, эректильной, фазе шока у пациента развивается простое психомоторное возбуждение. Пациент возбужден, беспокоен, мечется, кричит. Во второй, торпидной, фазе отмечается вялость, апатия, безразличие, крайняя пассивность. И в той, и в другой фазе шока пациент, как правило, не знает, где он находится и что с ним происходит, то есть он спутан, дезориентирован. В современной медицине большое количество исследований посвящено проблемам нарушений сознания в послеоперационном периоде и у реанимационных пациентов. В общетерапевтической клинике изменения сознания выявляются у 20% больных, преимущественно у пожилых. В отделениях реанимации и интенсивной терапии нарушения сознания развиваются значительно чаще - в 80% наблюдений [1].
Острым нарушениям сознания придается большое значение, поскольку они являются признаками нарастающего соматического неблагополучия или полиорганной недостаточности. При анализе современной литературы мы столкнулись с тем, что практически весь спектр нарушений сознания за исключением коматозных состояний, эпилептического статуса и деменции объединено понятием Delirium. Мы считаем это замечание очень важным, поскольку в отечественной психиатрической литературе под термином делирий подразумевается острый психоз с дезориентировкой, галлюцинациями, бредом, колеблющимся, чаще тревожным аффектом, двигательным и речевым возбуждением.
К сожалению, в отечественной реанимационной литературе уделяется недостаточно внимания проблеме нарушений сознания. Поэтому настоящий обзор основан главным образом на зарубежных публикациях. В том случае, когда делирий употребляется нами в трактовке русскоязычных авторов, он будет написан «Делирий», а в трактовке англоязычных авторов - “Delirium”.
Что такое делирий, с точки зрения психиатра?
Классическим психиатрическим определением делирия является: «Делирий (лат. Delirium: безумие, помешательство, от Delirare – отклоняться от прямой линии, безумствовать: de – отделение, устранение; lira – гряда, борозда) - вид помрачения сознания, клинически проявляющееся наплывом зрительных галлюцинаций, ярких чувственных парейдолий (парейдолия – это разновидность зрительных иллюзий, заключающиеся в формировании иллюзорных образов, в качестве основы которых выступают детали реального объекта, например, фигуры людей и животных в облаках, изображение человека на поверхности луны) и резко выраженным двигательным возбуждением. Развитие делирия свидетельствует о наличии соматического заболевания, инфекции или интоксикации» [2]. Состояние расстроенного сознания без четких признаков искажения восприятия рассматривается в рамках спутанности сознания.
Международная классификация болезней (МКБ-10) дает следующее описание delirium [3]. Delirium – это этиологически неспецифический синдром, характеризующийся сочетанным расстройством сознания и внимания, восприятия, мышления, памяти, психомоторного поведения, эмоций и ритма сон-бодрствование. Он может возникнуть в любом возрасте, но чаще после 60 лет. Delirium является преходящим и колеблющимся по интенсивности нарушением сознания. Начало delirium обычно острое, состояние в течение дня колеблющееся. Обычно выздоровление наступает в течение 4 недель или меньше. Однако протекающий с колебаниями delirium длительностью до 6 месяцев не является редким. Различия, которые иногда делаются между острым и подострым delirium , имеют небольшое клиническое значение и такие состояния должны рассматриваться как единый синдром различной длительности и степени тяжести (от легкой до очень тяжелой). Delirium может проявляться на фоне деменции или ей предшествовать. Для достоверного диагноза должны присутствовать легкие или тяжелые симптомы в каждой из следующих групп симптомов: (а) измененное сознание и внимание; сниженная способность направлять, фокусировать, поддерживать и переключать внимание); (б) глобальное расстройство познания (искажения восприятия, иллюзии и галлюцинации, в основном зрительные; нарушения абстрактного мышления и понимания с или без преходящего бреда, но обычно с некоторой степенью инкогеренции (инкогеренция - речевая бессвязность); нарушение непосредственного воспроизведения и памяти на недавние события с относительной сохранностью памяти на отдаленные события; дезориентировка во времени, а в более тяжелых случаях в месте и собственной личности); (в) психомоторные расстройства (гипо- или гиперактивность и непредсказуемость перехода от одного состояния к другому; повышенный или сниженный поток речи; реакции ужаса); (г) расстройства ритма сон-бодрствование (бессонница, а в тяжелых случаях - тотальная потеря сна или инверсия ритма сон-бодрствование: сонливость днем, ухудшение симптомов в ночное время; беспокойные сны или кошмары, которые при пробуждении, в промежуточном состоянии, могут продолжаться как галлюцинации – гипнопомпические галлюцинации, обманы восприятия, “dreamy state”); (д) эмоциональные расстройства, тревога или страхи. Раздражительность, эйфория, апатия или недоумение и растерянность. Достоверный диагноз delirium может быть поставлен, даже если не установлена его причина.
Американская Психиатрическая Ассоциация предлагает свои диагностические критерии делирия, которые были сформулированы в DSM-IV-TR (Diagnostic and Statistical Manual of Mental Disorders – справочник Ассоциации по диагностики психических заболеваний, издаваемый с 1970-х годов) [4]. Цитируемое издание было опубликовано в 1994 году и дополнено в 2000 году. Диагностические критерии delirium, сформулированные в DSM-IV-TR, приведены в Таблице 1.

Что такое delirium, с точки зрения реаниматолога?
Реаниматологическая трактовка понятия delirium является более широкой, чем психиатрическая, и, исходя из нее, получены данные, что delirium развивается у 60-80% реанимационных больных [5 - 13]. Однако при попытке диагностики delirium у реанимационных пациентов при помощи критериев, изложенных в DSM-IV-TR, стало очевидным, что в большинстве клинических ситуаций это по различным причинам невозможно. Например, оценить у интубированного пациента изменения, описанные в пунктах 1 и 2, крайне затруднительно. Еще одним серьезным препятствием для внедрения этих диагностических критериев в практику интенсивной терапии было то, что в США с помощью их диагностировать delirium имели юридическое право только психиатры [4, 14]. Исходя из этого, были созданы специальные методы диагностики delirium, которыми могли эффективно пользоваться интенсивисты в своей рутинной практике, а затем валидность этих методов была оценена при исследовании чувствительности и специфичности в их сравнении с критериями DSM-IV-TR [6, 7].
С точки зрения реаниматолога, Delirium – это остро развившийся клинический синдром, который проявляется изменением уровня сознания в сочетании со снижением внимания или дезорганизацией мышления [6]. Это определение отражает 5 принципиальных аспектов, которые позволяют отличать его от других состояний, которые также проявляются изменением уровня сознания и когнитивных функций.
Во-первых, delirium является исключительно клиническим синдромом. Это означает, что его можно и нужно диагностировать при клиническом осмотре пациента, и для этого не требуется применения каких-либо дополнительных лабораторных или инструментальных методов [15].
Во-вторых, delirium развивается остро, в течение короткого периода времени – от нескольких часов до нескольких суток [4] - и он всегда ассоциирован с воздействием какого-либо стрессового фактора – операции, травмы, острого инфекционного процесса, выраженного болевого синдрома, критического состояния и т.д. Еще одним клиническим показателем, который подчеркивает острое развитие delirium, является неустойчивость уровня сознания в течение предшествующих осмотру 24 часов [4]. Острота развития delirium позволяет провести дифференциальный диагноз с деменцией [16, 17]. При этих состояниях также выявляются изменения уровня сознания, снижение внимания и/или дезорганизованное мышление, однако, они существуют хронически, на протяжении длительного периода времени. В то же время, наличие у пациента деменции или корсаковского синдрома не исключает возможности развития у него делирия. Наоборот, грубые преморбидные когнитивные изменения достоверно повышают риск развития delirium при воздействии на пациента стрессорных факторов [18]. Таким образом, если изменения общемозговой неврологической симптоматики носят хронический и стабильный характер, то наличие delirium исключается.
В-третьих, delirium всегда проявляется изменением уровня сознания. Из этого постулата следуют два важных для диагностики делирия следствия [6]. Первое, уровень сознания должен быть выше сопора, и пациент не должен быть глубоко седатирован. Для этого используется шкала RASS (Таблица 2).

Пациент должен иметь оценку по RASS от +4 до -3. При RASS -4/-5 пациент не может быть оценен на предмет наличия у него delirium. В этом случае нужно повторять оценку пациента по шкале RASS в динамике. И, второе, пациент, на момент осмотра имеющий оценку по шкале RASS 0, может иметь delirium только в одном случае – если в течение предшествующих осмотру суток у него была неустойчивость уровня сознания, то есть если ранее у него была любая другая оценка по RASS, отличная от ноля. Таким образом, если пациент оценен по шкале RASS в ноль баллов, и у него был стабильный неврологический статус в течение предшествующих осмотру 24 часов, то у пациента нет delirium; если пациент имеет оценку по RASS -4/-5, то на момент осмотра пациент либо в коме, либо в глубокой седации, что требует повторной оценки по RASS в динамике.
В-четвертых, для диагностики делирия необходимо исследовать внимание. Сниженное внимание – это краеугольный камень delirium [4, 6, 7]. Нет снижения внимания – нет delirium. Можно выделить два основных вида нарушений внимания: (1) с трудностью привлечь внимание и (2) с невозможностью его удержать. Существует несколько тестов для определения сохранности внимания. Наиболее распространенным является следующий: пациента просят пожимать руку при произнесении буквы «А». Затем по буквам произносят: «SAVEAHAART». Если пациент делает менее трех ошибок, то внимание у пациента сохранно, и у него нет delirium. Если пациент совершает больше двух ошибок, то у него нарушено внимание, и у него вероятен delirium [19].
В-пятых, процесс диагностики делирия завершает выявление дезорганизации мышления или измененного уровня сознания [19]. При дезорганизованном мышлении пациент отвечает неправильно на 2 или более из следующих 4 вопросов: «Плавает ли камень в воде?», «Плавает ли рыба в небе?», «Тяжелее ли один килограмм двух?», «Можно ли использовать молоток для забивания гвоздей?». Или: «Плавает ли лист по воде?», «Живут ли слоны в море?», «Тяжелее ли 2 килограмма, чем один?», «Можно ли молотком срубить дерево?». Для некоторых пациентов, особенно нейрореанимационных, эти вопросы могут оказаться слишком сложными для ответа, поэтому, по нашему мнению, следует для диагностики дезорганизованного мышления использовать следующий тест. Пациенту предлагается показать два пальца правой рукой, а спустя несколько секунд – показать другой рукой на два пальца больше. Изменение уровня сознания констатируется при любой оценке по RASS, отличной от 0. Однако эти тесты имеют ограничения у пациентов с очаговым поражением лобно-височных отделов левого полушария: они не будут правильно отвечать и выполнять инструкции из-за афазии. Таким образом, если у пациента нет явных признаков дезорганизации мышления и по шкале RASS он оценен в ноль баллов, то у него нет delirium, тогда как при дезорганизации мышления или при RASS -3/+4 у пациента диагностируется delirium.
Описанная выше интерпретация определения delirium, по-сути, представляет собою алгоритм диагностики delirium, носящий название CAM-ICU (Confusion assessment method in intensive care init) (Рисунок 1) [6, 19].
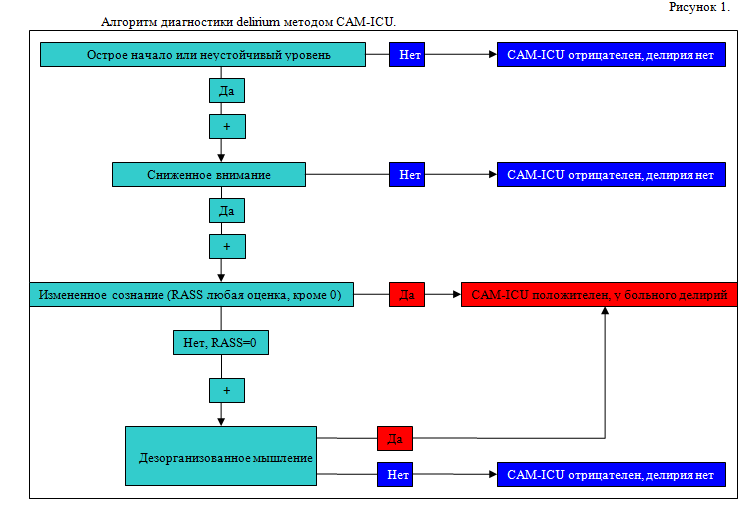
Альтернативным методом диагностики delirium у реанимационного пациента является использование специального контрольного листа - ICDSC (Intensive Care Delirium Screening Checklist) (Таблица 3) [7, 19].

Оба метода – CAM-ICU и ICDSC – показали свою валидность при использовании у реанимационных пациентов [20], а также достаточную чувствительность и специфичность для того, чтобы Американское Общество Критической Медицины (SCCM) рекомендовало их для рутинного использования у этой категории больных для диагностики delirium [21, 22].
Какой из двух методов использовать, решается в зависимости от специфики медицинского подразделения [18]. Однако оценить интубированного пациента на предмет наличия delirium возможно только при использовании CAM-ICU. ICDSC чаще в своей работе использует средний медицинский персонал, и этот метод является более удобным для диагностики субсиндромального delirium [23], о котором речь пойдет ниже. Внедрение CAM-ICU и ICDSC позволили интенсивистам правильно диагностировать delirium без участия психиатров [6, 7]. Существует много других шкал для диагностики delirium, но, поскольку они не применимы в условиях интенсивной терапии [20], то мы не обсуждаем их в настоящем обзоре.
Внедрение CAM-ICU и ICDSC в рутинную клиническую практику, безусловно, повысило диагностику delirium у реанимационных пациентов. Однако необходимо помнить, что причиной изменения уровня сознания и неустойчивого бодрствования могут быть структурные повреждения головного мозга или эпилептический статус. Так, Benbadis SR с соавт показали, что из 127 пациентов, находившихся в отделении реанимации, к которым был вызван невролог для их консультации по поводу изолированного изменения психического статуса, в 7% был диагностирован ишемический инсульт, а в 1% - субарахноидальное кровоизлияние [24]. Salerno D с соавт показали, что консультация неврологом по поводу «нарушений психического статуса» 123 пациентов, находившихся в терапевтической реанимации, выявила ишемический инсульт у 13 пациентов, геморрагический инсульт у 2 пациентов, опухоль головного мозга у 3 больных [25]. Известно, что безсудорожный эпилептический статус, в том числе проявляющийся признаками, характерными для делирия, возникает примерно у 35% нейрореанимационных пациентов и у 8-10% реанимационных пациентов, не имеющих патологии центральной нервной системы [26 - 31]. Приведенные исследования и статистические данные наглядно демонстрируют необходимость рутинного, ежедневного полноценного неврологического осмотра пациента, дополненного его оценкой методом CAM-ICU или ICDSC [32]. При подозрении на развитие или нарастание выраженности уже имеющейся интракраниальной патологии показана экстренная нейровизуализация (КТ-, МРТ-исследование головного мозга). Кроме этого, для исключения бессудорожного эпилептического статуса, необходимо выполнение ЭЭГ. Особенно это касается нейрореанимационных пациентов, которым показан непрерывный многочасовой ЭЭГ-мониторинг [32].
И все-таки, что такое delirium или причины терминологической путаницы.
Итак, delirium является клиническим проявлением острой дисфункции головного мозга [18]. Другими словами, delirium – это проявление острой органной церебральной недостаточности. Точно так же, как повышение уровня креатинина в сочетании с олигоанурией являются клиническими проявлениями острой почечной недостаточности (ОПН). Однако, в отличие от ОПН, которую все врачи во всех странах мира и при любой клинической ситуации вне зависимости от причины ее вызвавшей, всегда называют ОПН и никак иначе, delirium в разных клинических ситуациях, в разных странах называют по-разному [16, 18]. Вот только несколько синонимов делирия: «острая энцефалопатия», «острый мозговой синдром», «острая когнитивная недостаточность», «обратимая деменция», «экзогенный психоз», «острая церебральная недостаточность», «токсическая энцефалопатия», «метаболическая энцефалопатия», «септическая энцефалопатия», «алкогольный делирий», «реанимационный психоз», и т.д.
Основная причина терминологической путаницы заключается в том, что в течение длительного времени реаниматологи были лишены возможности адекватной прикроватной диагностики остро развившихся нарушений психического статуса у реанимационного пациента [33]. С появлением CAM-ICU и ICDSC реаниматологи имеют возможность унифицировать свои диагностические подходы к больным, у которых развились изменения уровня сознания и психические нарушения в отделении реанимации. Однако поиск мониторинговых систем или методов нейровизуализации, которые позволяли бы диагностировать delirium и дифференцировать его различную выраженность, является актуальной медико-инженерной задачей [18, 34]. В условиях отсутствия унифицированного подхода к диагностике изменений психического статуса, естественно, происходила попытка привязать эти изменения к этиологическому фактору. Так появлялись «токсическая энцефалопатия», «метаболическая энцефалопатия», «септическая энцефалопатия», «алкогольный делирий».
Еще одной причиной наличия такого разнообразия имен острому изменению сознания являются междисциплинарные различия в понимании медико-биологических явлений. Так, неврологи до сих пор предпочитают использовать термин «энцефалопатия» в сочетании с указанием этиологического фактора. Тогда как психиатры и реаниматологи чаще использовали понятие delirium [16]. И, наконец, существуют языковая специфика восприятия понятия делирий. Так, в одних странах под делирием чаще понимали алкогольный делирий, проявляющийся психомоторным возбуждением и ажитацией, а в других, под этим понятием понимали извращенное восприятие действительности, часто сопровождающееся галлюцинациями и иллюзиями [16, 35, 36] или изменения сознания и психического статуса, развивающиеся в послеоперационном или посттравматическом периоде [16]. Переход на единый язык, по всей видимости, является дело будущего.
Этиология delirium.
Факторы риска у пациентов с отсутствием структурных изменений в мозге.
В подавляющем большинстве случаев невозможно выделить какой-либо один ведущий фактор в качестве причины развития delirium [18]. Этиология delirium всегда многофакторна, поэтому принято выделять факторы риска. В литературе описано не менее 61 фактора риска, однако, на наш взгляд, методологически правильно разделять факторы риска на три группы [13, 15, 20, 37, 38, 39] как в Таблице №4
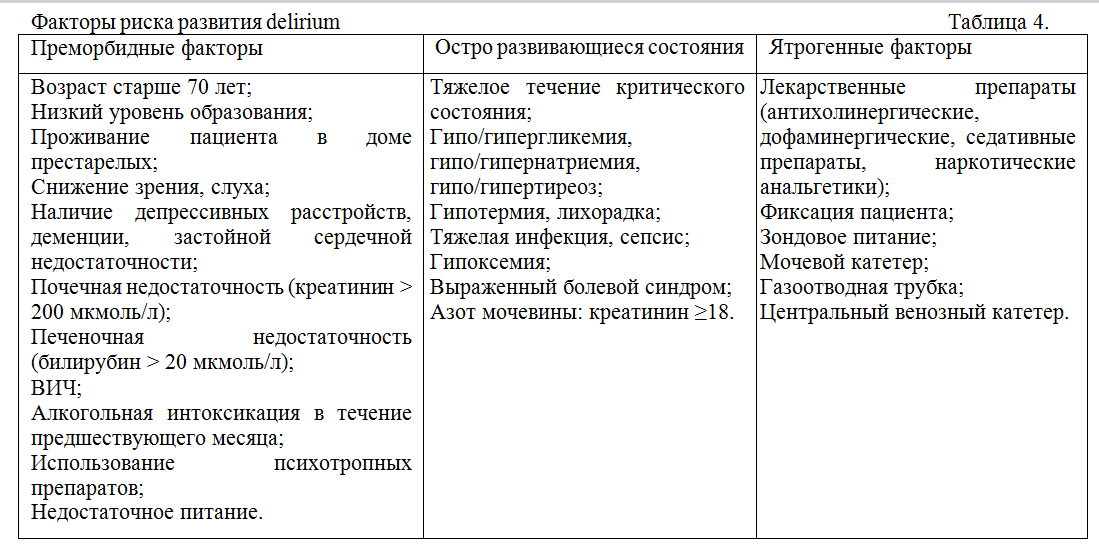
Среди этих факторов есть такие, которые при определенной тяжести критического состояния практически гарантированно приведут к развитию delirium. К таким факторам относятся наличие у пациента деменции, использование бензодиазепинов, развитие инфекционных осложнений.
Известно, что деменция повышает риск развития delirium в 6 раз [40], в то время как более высокий образовательный уровень его значительно снижает [18]. Точно также тяжелые инфекционные осложнения являются настолько типичными факторами риска развития delirium, что некоторые авторы считают delirium наиболее ранним клиническим проявлением этих осложнений [41]. Исходя из этого, существует точка зрения, что при развитии delirium у реанимационного пациента, прежде всего, необходимо исключить наличие инфекционных осложнений.
Использование бензодиазепинов увеличивает риск развития delirium в 3 раза [40]. Каждое разовое введение лоразепама повышает вероятность развития delirium на 20% , а при суммарной суточной дозе 20 мг у пациентов в 100% наблюдений развивается delirium [18]. Пропофол также рассматривается, как фактор риска развития delirium, хотя и в меньшей степени, чем бензодиазепины [18, 42]. Наркотические анальгетики способны приводить к развитию delirium, особенно, когда они используются, прежде всего, для седации и в комбинации с бензодиазепинами или пропофолом [18]. Однако, следует учитывать, что наличие некупированного болевого синдрома является мощным фактором риска развития delirium [20]. Поэтому адекватное использование наркотических анальгетиков для эффективного купирования остро развившегося болевого синдрома не только не приведет к развитию delirium, а, наоборот, будет предотвращать его появление. Наиболее опасной комбинацией в плане риска развития delirium является совместное использование бензодиазепинов и антихолинергических препаратов или бензодиазепинов и дофаминергических препаратов [18].
На сегодня нет седативных препаратов, которые бы достоверно уменьшали риск развития delirium. Вместе с этим в отдельных работах было показано, что при использовании альфа-симпатомиметических препаратов не только снижался риск развития delirium, но отмечалось восстановление нарушенных когнитивных функций. Это касается нового препарата - дексмедетомедина [42] и уже давно используемого - клонидина [18]. Существуют противоречивые данные о кетамине. Некоторые авторы сообщают о том, что он способен уменьшать риск развития delirium [43]. Однако на протяжении длительного времени считалось, что кетамин вызывает когнитивные нарушения [44].
Структурные повреждения головного мозга как причина delirium.
Краеугольными составляющими delirium являются изменение уровня сознания, снижение внимания и дезорганизация мышления. Уровень сознания обусловлен, прежде всего, адекватным функционированием ретикулярной формации (РФ), которая распространяется от моста мозга до передней поясной извилины. РФ получает импульсы от спинного мозга, зрительного и слухового анализаторов, таламуса, гипоталамуса. Кроме этого, РФ имеет обширные нейрональные связи с корой мозга, устроенные по типу обратной связи. Память, внимание и другие когнитивные функции обусловлены адекватным и координированным функционированием корковых отделов лобных долей, поясной извилины, таламуса, свода, мамиллярных тел, гиппокампа, подкорковых ядер [32]. Повреждение любой из перечисленных выше анатомических структур может приводить к развитию delirium [32].
Известно, что delirium тесно связан с диссомнией [45 - 49]. При delirium всегда выявляются нарушения сна. Однако остаются невыясненными причинно-следственные взаимоотношения этих явлений [50]. Другими словами, не известно, является ли депривация сна причиной delirium, или нарушения сна развиваются вследствие delirium. Сон-бодрствование является классическим примером циркадного ритма, который регулируется согласованной работой РФ, ядер гипоталамуса (латеральные и вентро-латеральные ядра) и базальных отделов лобных долей [51 - 54]. РФ и гипоталамические ядра функционируют разнонаправлено – когда РФ «включена», а вентро-латеральные ядра гипоталамуса «выключены», человек бодрствует и, наоборот, когда РФ «выключена», а ядра гипоталамуса «включены», наступает сон [51 - 54]. Интересно, что при структурном повреждении РФ, вентро-латеральных отделов гипоталамуса и лобных долей всегда развивается delirium [50]. Таким образом, Figueroa-Ramos MI с соавт делают заключение о том, что структурные повреждения, приводящие к delirium и диссомнии, фактически одинаковы [50].
Патогенез delirium.
Патогенез делирия до сих пор остается предметом научного поиска и вопросом активной дискуссии. Это обусловлено тем, что отчетливое понимание патогенеза delirium может позволить оптимизировать терапию и, в конечном итоге, улучшить результаты лечения пациентов с delirium. На сегодня считается, что одним из звеньев патогенеза является дисбаланс между холинергической и дофаминергической нейротрасмиттерными системами [18, 55 - 59], а именно - снижение уровня ацетилхолина и увеличение уровня дофамина. Причем это уменьшение или увеличение может быть как абсолютным, так и относительным по отношению к антагонистическому медиатору. Важным доказательством правильности этой гипотезы является достаточно высокая клиническая эффективность галоперидола – мощного блокатора дофаминергической системы мозга – в лечении пациентов с delirium [60]. С другой стороны, терапия препаратами дофамина достоверно повышает риск развития delirium [60], что еще раз свидетельствует в пользу этой гипотезы патогенеза делирия.
Существуют другие медиаторные системы, которые, вероятно, так же участвуют в патогенезе delirium, но, какую именно роль они в этом играют, остается не понятным. Это серотонин, гамма-аминомасляная кислота, глутамат, гистамин, норадреналин [55 - 61]. Значимость этих медиаторных систем подтверждается эффективностью атипичных нейролептических препаратов, которые гораздо избирательнее, чем галоперидол, воздействуют на дофаминергические рецепторы, блокируя при этом серотониновые, гистаминовые и другие рецепторы [62]. Значение альфа-симпатомиметических препаратов – дексмедетомедина и клонидина – в профилактике, а, возможно, и в лечение delirium также доказывают участие в его патогенезе не только исключительно серотонина и дофамина, но и других медиаторных систем [18, 42].
Интересную точку зрения представляют собою работы Lewis MC с соавт и Balan S с соавт [63, 64]. Lewis MC с соавт считают, что патогенез delirium заключается в нарушении метаболизма триптофана, а Balan S с соавт выдвинули гипотезу, исходя из которой, при delirium нарушается метаболизм мелатонина. Однако, поскольку мелатонин принимает активное участие в регуляции циркадных ритмов и, в частности, ритма сон-бодрствование, а при delirium развивается диссомния, то остается непонятным значение сниженного уровня мелатонина при delirium. Возможно, это является биохимическим отражением угнетения циркадных ритмов при delirium.
При развитии инфекции у пациентов, находящихся в отделении реанимации, развитие delirium типично [41]. Установлена достоверная корреляция между уровнем провосполительных цитокинов, биохимических маркеров воспаления и развитием delirium, а также его тяжестью [65 - 68]. Однако остается непонятным, способны ли эти биологически активные вещества органически повреждать различные структуры мозга и вызывать delirium, или они только лишь провоцируют биохимический и нейротрасмиттерный дисбаланс в головном мозге.
Классификация delirium.
При клиническом осмотре delirium разделяют на гипоактивный, гиперактивный, смешанный [69 - 73]. Кроме этого, ряд авторов выделяют субсиндромальный delirium [23]. Гипоактивный, гиперактивный и смешанный делирий дифференцируют в зависимости от того, какую оценку по RASS имеет пациент [69]. При RASS +1/+4 диагностируется гиперактивный delirium, при RASS 0/-3 – гипоактивный, а при неустойчивости пациента в пределах оценки по RASS +4/-3 delirium является смешанным, который выявляется наиболее часто.
У ряда пациентов развивается синдром, очень похожий с delirium, но, если их оценить по CAM-ICU или ICDSC, то станет понятным, что они не полностью удовлетворяют всем критериям, необходимым для диагностики delirium. Cole M с соавт ввели термин субсиндромального delirium [73]. Субсиндромальный delirium развивается в тех же клинических условиях, что и обычный delirium. Для диагностики используется ICDSC. При ICDSC 0 у пациента нет delirium, при ICDSC ≥ 4 пациент имеет развернутый delirium, а при ICDSC 1-3 у пациента диагностируют субсиндромальный delirium. Чувствительность ICDSC для диагностики субсиндромального delirium выше, чем у CAM-ICU. Так, например, наличие галлюцинаций не учитывается CAM-ICU, и delirium может протекать как с галлюцинациями, так и без них. Но острое появление галлюцинаций может быть единственным проявлением субсиндромального delirium, что не будет диагностировано при помощи CAM-ICU [23, 71 - 75].
Выделение субсиндромального delirium оправдано, поскольку его диагностика позволяет начать своевременную и адекватную терапию, не дожидаясь ухудшения клинической симптоматики и формирования развернутого delirium. Пациенты с субсиндромальным delirium занимают промежуточное положение – между пациентами, не имеющими delirium, и делириозными больными - по тяжести течения критического состояния и исходам [23, 71 - 75].
Понятие субсиндромальный delirium до сих пор не является общепринятым. Выделялись и продолжают выделяться пограничные состояния между нормальным уровнем сознания и delirium [76, 77]. Однако они называются по-разному. Им безосновательно дают различные некорректные названия, например, «депрессивные нарушения». Иногда авторы приводят очень запутанные классификации нарушений сознания. Например Jurban A с соавт нарушения сознания у реанимационных пациентов разделили на кому, delirium и когнитивные нарушения [76]. При этом делириозные и коматозные пациенты после разделения были вновь объединены в одну группу, чтобы затем разделить их на подгруппу, в которой сознание в конечном итоге восстановилось, и подгруппу, в котором восстановления сознания не было, и пациенты скончались. Кроме этого, пациенты с когнитивными нарушениями были разделены на больных, имевших депрессию и пациентов без депрессии. Однако для развития депрессии необходима достаточная ясность сознания. По-сути, авторы описывали пациентов с субсиндромальным delirium – условия, в которых развились изменения сознания, не отличались от условий, в которых развился delirium, и все пациенты, если их оценивать по ICDSC имели по нескольку баллов, а исходы их лечения были хуже, чем у пациентов без нарушений сознания, но лучше, чем у больных с delirium. Минусы от создания своих классификаций нарушений сознания очевидны. Это – терминологическая путаница, невозможность воспроизведения дизайна исследования в других клиниках, что не даст возможности сравнивать тяжесть состояния пациентов, результаты лечения этих пациентов и исходы, то есть терминологическая путаница лишает возможности проведения многоцентровых исследований. Но самое главное, пациенты не получают адекватной терапии.
Формирование представлений о типах delirium позволили по-другому увидеть классификацию нарушений сознания у реанимационных пациентов, исходно не имеющих патологии центральной нервной системы [16, 23]. При RASS -4/-5 у пациента диагностируется коматозное состояние. Пациенты, имеющие RASS +4/-3, оцениваются методом ICDSC. При ICDSC 0 пациент не имеет нарушений сознания, при ICDSC 1-3 у пациента диагностируется субсиндромальный delirium, при ICDSC ≥ 4 пациент имеет развернутый delirium. Другими словами, реанимационный пациент без патологии центральной нервной системы может иметь всего три состояния сознания: ясное сознание, коматозное состояние или delirium. Такое разделение имеет непосредственное влияние на исходы, поскольку, если у пациента обнаруживаются нарушения сознания, и он находится не в коме, то ему необходимо начать терапию, направленную на коррекцию delirium.
Более сложная ситуация возникает при трактовке изменений уровня сознания у нейрореанимационных пациентов, то есть у реанимационных больных с исходным повреждением центральной нервной системы. Нам представляется следующее распределение состояний сознания у нейрореанимационных пациентов (Рисунок 2).
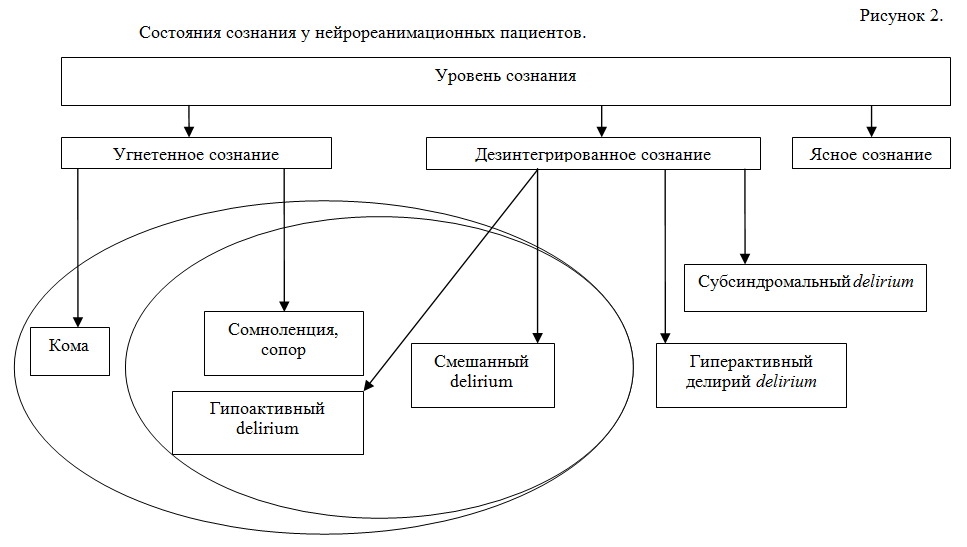
Клиническая интерпретация нарушений уровня сознания у нейрореанимационных пациентов является актуальной задачей, которая должна стать целью дальнейших научных исследований.
Статистика.
Интерес к проблеме delirium возрос с начала 2000-х годов [16]. По данным поисковой системы PubMed в период с 1990 по 1999 год на эту тему ежегодно публиковалось от трех до 12 статей, а начиная с 2000 года – от 20 до 60 работ. Это не является случайным, поскольку delirium развивается у 20-40% нереанимационных пациентов и у 60-80% реанимационных больных [5 – 9, 11 – 13, 70, 77]. Delirium существенно утяжеляет течение заболевания пациента и ухудшает исходы. Исследования у госпитализированных нереанимационных пожилых пациентов показали, что развитие delirium ассоциировано с увеличением числа различных осложнений [37, 78 - 80], плохим функциональным исходом [81], увеличенной госпитальной смертностью [79, 82] и смертностью в течение двух лет после выписки из клиники [83]. При развитии delirium у пациентов с деменцией смертность в течение 12 месяцев после выписки увеличивается вдвое [84]. Delirium является независимым предиктором более длительного пребывания в реанимации [85, 86], более высокой стоимости лечения [87]. При delirium риск смерти в течение последующих 6 месяцев возрастает в три раза [12]. Delirium ассоциирован так же с долгосрочными когнитивными нарушениями [88] и сниженным качеством жизни после выписки пациента из стационара [89, 90].
По данным Peterson JF с соавт, гипоактивный делирий встречается в 43,5% наблюдений, смешанный delirium – в 54,1%, гиперактивный – в 1,6% [9]. О подобном распределении сообщают и другие авторы [70, 72, 91, 92]. При этом гиперактивный delirium является наиболее прогностически благоприятным, поскольку он является наиболее хорошо выявляемой формой delirium и, соответственно, эти пациенты своевременно получают адекватную терапию [91]. Кроме этого, в отличие от гипоактивного и смешанного delirium для развития гиперактивного delirium необходимо отсутствие грубых структурных нарушений мозга и относительная сохранность функциональных связей между его различными отделами. Другая ситуация складывается у пациентов с гипоактивным delirium, у которых он остается невыявленным в 66-84% [37, 79, 93, 94], и эти пациенты не получают адекватной целенаправленной терапии. Вместе с этим пациенты с гипоактивным delirium имеют, как правило, более выраженное повреждение мозга.
Пациенты с субсиндромальным delirium занимают промежуточное положение между delirium и пациентами, не имеющих нарушений сознания. Это касается времени пребывания пациентов в реанимации, длительности ИВЛ, тяжести состояния при нахождении в реанимации, исходов и качества функционального восстановления и сохранности их когнитивных функций после выписки из стационара [23, 73, 74].
Лечение пациентов с delirium.
Задачей первостепенной важности в лечении пациента с delirium является раннее выявление возможной причины или вероятных факторов риска и незамедлительная их коррекция [18]. Очевидно, что не все факторы риска могут быть корригированы. К таким относятся, например, предшествующая критическому состоянию деменция или старческий возраст. Однако существует большое количество существенных и потенциально корригируемых факторов риска. Это, прежде всего, гомеостатические нарушения, инфекционные осложнения, болевой синдром и все ятрогенные факторы. Следует ограничить седацию пациента, избегая при этом использования бензодиазепинов. Ситуации, при которых они применяются, необходимо сузить до коррекции судорог и лечения делирия, развившегося вследствие отмены алкоголя [95]. В отделении реанимации не должна практиковаться необдуманная фиксация пациентов. Пребывание родственников рядом с пациентом способно существенно уменьшить необходимость фиксации пациента. Назогастральный зонд, мочевой и центральный венозный катетер должны быть удалены как можно раньше [18]. Кроме этого, очень важно, чтобы у пациентов, использовавших в повседневной жизни слуховые приборы или очки, была возможность пользоваться ими при нахождении в реанимации. В пределах видимости должны располагаться часы и календарь с отметкой сегодняшней даты [96, 97]. Работа реанимации должна быть построена таким способом, чтобы в дневные часы помещение максимально освящалось дневным светом, а в вечерние и ночные освещение было приглушенным [18]. Максимальный объем рутинных лечебных манипуляций и мероприятий по уходу должны проводиться в дневные часы. Время ночного отдыха пациентов должно быть по возможности максимально увеличено. С пациентом необходимо проводить активные реабилитационные мероприятия, причем начинаться они должны в как можно ранние сроки [18, 96, 97]. Этими отчасти простыми и логичными мероприятиями нельзя пренебрегать, поскольку они способны существенно улучшить ситуацию.
Основой фармакологической коррекции бреда, галлюцинаций, возбуждения до последнего времени являются нейролептические препараты [18]. Препаратом выбора долгое время был галоперидол, который является классическим представителем типичных нейролептиков [98]. Во всех международных и национальных руководствах по лечению Delirium он пока остается препаратом первой линии [18]. Основной причиной этого является то, что с 1957 года, когда галоперидол был введен в клиническую практику, накоплен огромный опыт применения этого препарата. В целом, галоперидол является относительно безопасным препаратом у пациентов с делирием [17]. Он блокирует дофаминергические рецепторы, и это является основой его действия [99, 100]. Существуют различные формы этого препарата, но в реанимации наиболее употребима парентеральная форма. Галоперидол можно вводить внутримышечно, внутривенно болюсно и внутривенно в виде продленной инфузии и даже в виде продленной подкожной инфузии. Своего максимального клинического эффекта галоперидол достигает не сразу, а спустя определенный период времени, который в зависимости от индивидуальных особенностей, может составлять от нескольких часов до несколько суток систематического использования. Период полувыведения составляет12 – 35 часов. Это является причинами сложности подбора адекватной дозы. Большинство руководств содержат рекомендации о начальной дозе галоперидола 2,5 – 5 мг, внутривенно с последующим добавлением препарата до достижения клинического эффекта. Поскольку начать действовать галоперидол может только через 30 минут после внутривенного введения, то, как правило, повторять его введения рекомендуют через 30 – 60 минут. Это так называемый «метод титрации». Максимальную суточную дозу галоперидола назвать чрезвычайно сложно. Есть сообщения о безопасном использовании 975 мг галоперидола в сутки [101 – 103]. Однако, такие сверхдозы галоперидола не дают лечебных эффектов и их использовать нецелесообразно.
Основными побочными эффектами галоперидола являются экстрапирамидные расстройства, нарушения сердечного ритма и злокачественный нейролептический синдром. Экстрапирамидные нарушения являются наиболее частыми. Известно, что при его парентеральном введении экстрапирамидные нарушения развиваются гораздо реже, чем при энтеральном введении [18]. При отмене галоперидола экстрапирамидные нарушения в большинстве наблюдений быстро регрессируют. Однако в ряде ситуаций, особенно у пациентов с органическими повреждениями мозга, развиваются острые дистонии, в том числе акатизия (клинический синдром, характеризующийся постоянным или периодически возникающим чувством внутреннего двигательного беспокойства и проявляющийся в неспособности больного долго сидеть спокойно в одной позе или долго оставаться без движения), синдром Куленкамфа-Тарнова (непреодолимое стремление открывать рот и высовывать язык; повышение тонуса и судороги жевательной и мимической мускулатуры и мышц затылка; гиперрефлексия и гиперсаливация; пароксизмальная спастическая кривошея, опистотонус, брадипноэ), окулогирные кризы (эпизодическая содружественная девиация глаз, обычно вверх и латерально, редко — вниз или строго латерально). Эти нарушения могут сохраняться в течение длительного времени – от нескольких часов до нескольких суток, а то и - недель. При длительном применении галоперидола возможно развитие паркинсоноподобных расстройств, которые дляться несколоко месяцев, иногда – годы. У пациентов с удлиненным интервалом QT галоперидол может вызвать мультиформную желудочковую аритмию – Torsades de pointes – которая, в свою очередь, может трансформироваться в желудочковую фибрилляцию. Torsades de pointes чаще возникает при использовании высоких доз галоперидола у пациентов с гипокалиемией, гипокальцемией, гипомагнемией и гипотиреозом [18]. В этих случаях необходима отмена галоперидола и применение магнезии. Злокачественный нейролептический синдром является грозным осложнением, имеющим 10% летальность. Это идиосинкратическая реакция в ответ на галоперидол, проявляющаяся гипертермией, выраженной ригидностью мышц и лабильностью вегетативной нервной системы. Диагноз устанавливается путем исключения причин, которые приводят к гипертермии, метаболическому ацидозу и повышению уровня креатинин киназы. Основой терапии является использование дантролена. Кроме этих осложнений описан синдром внезапной смерти при использовании нейролептиков [104 - 106]. Это наименее изученный синдром, объяснения которому на сегодня не существует.
Одним из наиболее интересных парадоксов является то, что, не смотря на длительную историю использования галоперидола, отсутствуют рандомизированные многоцентровые исследования, изучающие особенности его использования у пациентов с delirium. Наиболее значимым исследованием является работа Milbrant с соавт, которые изучали влияние использования галоперидола у реанимационных пациентов, которым нуждались в проведении ИВЛ в течение более 48 часов. Авторы показали, что у пациентов, которые получали галоперидол, летальность была достоверно ниже (21%) по сравнению с не получавшими его (36%) [107]. Было предложено три возможных объяснения полученных результатов. Использование галоперидола уменьшает необходимость использования седативных и наркотических препаратов, в частности, бензодиазепинов. Delirium блокирует контроль нервной системы над иммунной, а коррекция delirium восстанавливает этот контроль. И, наконец, галоперидол способен снижать выброс цитокинов, что предотвращает органное повреждение.
Хорошей альтернативой галоперидолу стали появившиеся в последние годы атипичные нейролептики [18]. Наиболее часто из препаратов этой группы используют кветиапин (сероквель), рисперидон (рисполепт), оланзапин (зипрекса). Они воздействуют на гистаминовые, серотониновые, норадреналинергические рецепторы, более избирательно воздействуют на дофаминовые рецепторы, как правило, не вызывая при этом экстрапирамидных побочных эффектов. Кроме этого, атипичные нейролептики в меньшей степени, чем галоперидол, ведут к когнитивному дефициту. К сожалению, они, как правило, имеют только энтеральную форму введения. Исключением является зипрекса. Другой альтернативой типичным нейролептикам могут стать небензодиазепиновые транкцилизаторы, например, фенибут, который успешно используется, как самостоятельно, так и в комбинации с атипичными нейролептиками.
Отдельной интересной и сложной задачей является лечение пациентов с гипоактивным delirium [18], который в отечественных психиатрических руководствах назывался «тихой спутанностью» [108]. С одной стороны, для этих пациентов, как и для больных с другими типами delirium, возможно, показаны нейролептические препараты. С другой стороны, эти пациенты имеют сниженный уровень бодрствования, и галоперидол, и атипичные нейролептики, нельзя использовать у этой категории пациентов, поскольку при их применении уровень сознания может еще больше снизиться. Возможно, этой группе пациентов целесообразнее назначать холиномиметические препаратами (цитиколин, ипидакрин, холина альфосцират и др), что должно быть подтверждено или опровергнуто дальнейшими исследованиями.
Заключение
Проведенный обзор литературы наглядно показал, что нарушения сознания являются актуальной проблемой у реанимационных пациентов. Нарушенное сознание в сочетании с полиорганной дисфункцией ухудшает исход основного заболевания. Длительное время отсутствовал единый подход к описанию нарушенного сознания у реанимационного пациента. В результате возникло большое количество синонимов, описывающих, по-сути, нарушенное сознание, но акцентирующих свое внимание на отдельных этиологических, патогенетических или клинических составляющих этого синдрома. Внедрение в клиническую практику шкал CAM-ICU или ICDSC позволило унифицировать диагностический подход. В результате большинство авторов нарушения сознания у реанимационных пациентов стали называть delirium. Это вошло в определенные классификационные и терминологические противоречия с представлениями отечественной психиатрической школы, но у реаниматолога появился практичный диагностический инструмент, позволяющий своевременно выявлять у пациентов нарушенное сознание. В результате стало возможным внедрение в повседневную клиническую практику широкого спектра целенаправленных мероприятий, направленных на профилактику и лечение delirium у реанимационных пациентов. Таким образом, широкое внедрение в отечественную практику подходов к диагностике, профилактике и лечению delirium у реанимационных пациентов является целесообразным.
Литература
- Patel RP, Gambrell M, Speroff T, et al. Delirium and sedation in the intensive care unit: Survey of behaviors and attitudes of 1384 healthcare professionals. Crit Care Med 2009; 37(3):825-832.
- Большая советская энциклопедия. Москва, третье издание, 1970-1978 г.
- МКБ-10: Международная статистическая классификация болезней. 10 пересмотр. Медицина, 2003.
- American Psychiatric Association «Diagnostic and statistical manual of mental disorders, Fourth Edition, Text Revision: DSM-IV-TR». — Washington, DC: American Psychiatric Publishing, Inc., 2000. — ISBN 0890420254
- McNicoll L, Pisani MA, Zhang Y, et al Delirium in the intensive care unit: occurrence and clinical course in older patients. J Am Geriatr Soc 2003, 51:591–598
- Ely EW, Inouye SK, Bernard GR, et al Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA 2001, 286:2703–2710
- Bergeron N, Dubois MJ, Dumont M, Dial S, Skrobik Y. Intensive Care Delirium Screening Checklist: evaluation of a new screening tool. Intensive Care Med 2001, 27:859–864.
- Thomason JW, Shintani A, Peterson JF, et al. Intensive care unit delirium is an independent predictor of longer hospital stay: a prospective analysis of 261 nonventilated patients. Crit Care 2005, 9:R375– R381.
- Peterson JF, Pun BT, Dittus RS, et al. Delirium and its motoric subtypes: a study of 614 critically ill patients. J Am Geriatr Soc 2006, 54:479–484
- Pandharipande P, Cotton BA, Shintani A, et al. Motoric subtypes of delirium in mechanically ventilated surgical and trauma intensive care unit patients. Intensive Care Med 2007, 33:1726–1731.
- Ely EW, Margolin R, Francis J, et al. Evaluation of delirium in critically ill patients: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit Care Med 2001, 29:1370–1379 1914.
- Ely EW, Shintani A, Truman B, et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004, 291:1753– 1762.
- Dubois MJ, Bergeron N, Dumont M, et al. Delirium in an intensive care unit: a study of risk factors. Intensive Care Med 2001, 27:1297– 1304.
- Ely EW, Siegel MD, Inouye SK. Delirium in the intensive care unit: an under-recognized syndrome of organ dysfunction. Semin Respir Crit Care Med 2001, 22:115–126.
- Pandharipande P, Jackson J, Ely EW (2005) Delirium: acute cognitive dysfunction in the critically ill. Curr Opin Crit Care 11:360–368.
- Morandi A, Pandharipande P, Trabucchi M, et al. Understanding international differences in terminology for delirium and other types of acute brain dysfunction in critically ill patients. Intensive Care Med 2008, 34:1907-1915.
- Laureys S, Owen AM, Schiff ND. Brain function in coma, vegetative state, and related disorders. Lancet Neurol 2004, 3:537–546.
- Page V, Ely EW. Delirium in critical care. Cambridge. 2011.
- www.icudelirium.org
- Delvin JW, Fong JJ, Fraser GL, Riker RR. Delirium assessment in the critically ill. Intensive Care Med 2007, 33:929-940.
- Jacobi J, Fraser GL, Coursin DB, et al (2002) Clinical practice guidelines for the sustained use of sedatives and analgesics in the critically ill adult. Crit Care Med 30:119–141.
- Ely EW, Stephens RK, Jackson JC, Et al. (2004) Current opinions regarding the importance, diagnosis, and management of delirium in the intensive care unit: a survey of 912 healthcare professionals. Crit Care Med 32:106–112
- Ouimet S, Riker R, Bergeon N, et al. Subsyndromal delirium in the ICU: evidence for a disease spectrum. Intensive Care Med 2007, 33:1007-1013.
- Benbadis SR, Sila CA, Cristea RL. Mental status changes and stroke. J Gen Intern Med. 1994;9:485–7.
- Salerno D, Marik PE, Daskalakis C, Kolm P, Leone F. The role of head computer tomographic scans on the management of MICU patients with neurological dysfunction. J Intensive Care Med. 2009;24:372–5.
- Claassen J, Mayer SA, Kowalski RG, Emerson RG, Hirsch LJ. Detection of electrographic seizures with continuous EEG monitoring in critically ill patients. Neurology. 2004;62:1743–8.
- Jordan KG. Neurophysiologic monitoring in the neuroscience intensive care unit. Neurol Clin. 1995;13:579–626.
- Privitera M, Hoffman M, Moore JL, Jester D. EEG detection of nontonic-clonic status epilepticus in patients with altered consciousness. Epilepsy Res. 1994;18:155–66.
- Vespa PM, O’Phelan K, Shah M, et al. Acute seizures after intracerebral hemorrhage: a factor in progressive midline shift and outcome. Neurology. 2003;60:1441–6.
- Towne AR, Waterhouse EJ, Boggs JG, et al. Prevalence of nonconvulsive status epilepticus in comatose patients. Neurology. 2000;54:340–5.
- Oddo M, Carrera E, Claassen J, Mayer SA, Hirsch LJ. Continuous electroencephalography in the medical intensive care unit. Crit Care Med. 2009;37:2051–6.
- Frontera JA. Delirium and sedation in the ICU. Neurocrit Care 2011, 14:463-474.
- Armstrong SC, Cozza KL, Watanabe KS (1997) The misdiagnosis of delirium. Psychosomatics 38:433–439.
- Morandi A, Gunter ML, Vasilevskis EE, et al. Neuroimaging in delirious intensive care unit patients: a preliminary case series report. Psychiatry 2010, 7(9):28-33.
- McGuire BE, Basten CJ, Ryan CJ, Gallagher J () Intensive care unit syndrome: a dangerous misnomer. Arch Intern Med 2000, 160:906–909.
- Granberg Axell AI, Malmros CW, et al. Intensive care unit syndrome/delirium is associated with anemia, drug therapy and duration of ventilation treatment. Acta Anaesthesiol Scand 2002, 46:726–731.
- Inouye SK (1994) The dilemma of delirium: clinical and research controversies regarding diagnosis and evaluation of delirium in hospitalized elderly medical patients. Am J Med 97:278–288.
- McGuire BE, Basten CJ, Ryan CJ, Gallagher J (2001) Intensive care unit syndrome: a dangerous misnomer. Arch Intern Med 160:906–909.
- Pisani MA, McNicoll L, Inouye SK (2003) Cognitive impairment in the intensive care unit. Clin Chest Med 24:727–737.
- Pisani MA, Murphy TE, Van Ness PH, et al. Characteristics associated with delirium in older patients in a medical intensive care unit. Arch Intern Med. 2007, 167(15):1629-34.
- van Gool WA, van de Beek D, Eikelenboom P. Systemic infection and delirium: when cytokines and acetylcholine collide. Lancet. 2010;375(9716):773-5.
- Mirski MA, Lewin III JJ, LeDroux S, et al. Cognitive improvement during continous sedation in critically ill, awake and responsive patients: the Acute Neurological ICU Sedation Trial (ANIST). Intensive Care Med 2010, 36:1505-1513.
- Hudetz JA, Patterson KM, Iqbal Z, et al. Ketamine attenuates delirium after cardiac surgery with cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 2009;23(5):651-657.
- Levänen J, Mäkelä ML, Scheinin H. Dexmedetomidine premedication attenuates ketamine-induced cardiostimulatory effects and postanesthetic delirium. Anesthesiology. 1995, 82(5):1117-25.
- Johns MW, Large AA, Masterton JP, Dudley HA Sleep and delirium after open heart surgery. Br J Surg 1974, 61:377–381
- Harrell RG, Othmer E. Postcardiotomy confusion and sleep loss. J Clin Psychiatry 1987, 48:445–446
- Sveinsson IS. Postoperative psychosis after heart surgery. J Thorac Cardiovasc Surg 1975, 70:717–726
- Helton MC, Gordon SH, Nunnery SL. The correlation between sleep deprivation and the intensive care unit syndrome. Heart Lung 1980, 9:464–468
- Yildizeli B, Ozyurtkan MO, Batirel HF, et al. () Factors associated with postoperative delirium after thoracic surgery. Ann Thorac Surg 2005, 79:1004–1009.
- Figueroa-Ramos MI, Arroyo-Novoa CM, Lee KA, et al. Sleep and delirium in ICU patients: a review of mechanisms and manifestations. Intensive Care Med 2009, 35:781-795.
- Harris CD Neurophysiology of sleep and wakefulness. Respir Care Clin N Am 2005, 11:567–586
- Saper CB, Scammell TE, Lu J. Hypothalamic regulation of sleep and circadian rhythms. Nature 2005, 437:1257–1263
- Manns ID, Mainville L, Jones BE. Evidence for glutamate, in addition to acetylcholine and GABA, neurotransmitter synthesis in basal forebrain neurons projecting to the entorhinal cortex. Neuroscience 2001, 107:249–263
- Verret L, Goutagny R, Fort P, et al. A role of melanin-concentrating hormone producing neurons in the central regulation of paradoxical sleep. BMC Neurosci 2003, 4:19
- Trzepacz PT. Update on the neuropathogenesis of delirium. Dement Geriatr Cogn Disord 1999, 10:330–334.
- Trzepacz PT. Delirium. Advances in diagnosis, pathophysiology, and treatment. Psychiatr Clin North Am 1996, 19:429–448
- Dysken MW, Skare SS, Burke MS, Mach JR Jr, Galka T, Billington CJ. Intrasubject reproducibility of growth hormonereleasing hormone-stimulated growth hormone in older women, older men, and younger men. Biol Psychiatry. 1993;33:610–7.
- Tune L, Carr S, Cooper T, Klug B, Golinger RC. Association of anticholinergic activity of prescribed medications with postoperative delirium. J Neuropsychiatry Clin Neurosci. 1993;5:208–10.
- Flacker JM, Lipsitz LA. Neural mechanisms of delirium: current hypotheses and evolving concepts. J Gerontol A Biol Sci Med Sci. 1999;54:B239–46.
- Trzepacz PT The neuropathogenesis of delirium. A need to focus our research. Psychosomatics 1994, 35:374–391
- Sommer BR, Wise LC, Kraemer HC. Is dopamine administration possibly a risk factor for delirium? Crit Care Med 2002, 30:1508–1511
- Gareri P, De Fazio P, Stilo M, et al. Conventional and Atypical Antipsychotics in the Elderly: Atypical Antipsychotics. Clinical Drug Investigation 2003, 23:287-322.
- Lewis MC, Barnett SR Postoperative delirium: the tryptophan dyregulation model. Med Hypotheses 2004, 63:402–406.
- Balan S, Leibovitz A, Zila SO, et al. The relation between the clinical subtypes of delirium and the urinary level of 6-SMT. J Neuropsychiatry Clin Neurosci 2003, 15:363–366.
- Wijdicks EF, Stevens M () The role of hypotension in septic encephalopathy following surgical procedures. Arch Neurol 1992, 49:653–656.
- Beloosesky Y, Grinblat J, Pirotsky A, et al. () Different C-reactive protein kinetics in postoperative hip-fractured geriatric patients with and without complications. Gerontology 2004, 50:216–222.
- Flacker JM, Wei JY () Endogenous anticholinergic substances may exist during acute illness in elderly medical patients. J Gerontol A Biol Sci Med Sci 2001, 56:M353–M355.
- Stefano GB, Bilfinger TV, Fricchione GL. The immune-neurolink and the macrophage: postcardiotomy delirium, HIV-associated dementia and psychiatry. Prog Neurobiol. 1994;42:475–88.
- Peterson JF, Pun BT, Dittus RS, et al Delirium and its motoric subtypes: a study of 614 critically ill patients. J Am Geriatr Soc 2006, 54:479–484.
- Pandharipande P, Cotton BA, Shintani et al. Motoric subtypes of delirium in mechanically ventilated surgical and trauma intensive care unit patients. Intensive Care Med 2007, 33:1726–1731
- Lipowski ZJ Delirium: acute confusional states, Revision edn. Oxford University Press, 1990, New York.
- Meagher DJ, Hanlon DO, Mahony EO, et al. Relationship between symptoms and motoric subtype of delirium. J Neuropsychiatry Clin Neurosci 2000, 12:51–56.
- Cole M, McCusker J, Dendukuri N, Han L. The prognostic significance of subsyndromal delirium in elderly medical inpatients. J Am Geriatr Soc 2003, 51:754–760.
- Marcantonio ER, Ta T, Duthrie E, Resnick NM Delirium severity and psychomotor types: their relationship with outcomes after hip fracture repair. J Am Geriatr Soc 2002, 50:850–857.
- Levkoff SE, Yang FM, Liptzin B Delirium: the importance of subsyndromal states. Prim Psychiatry 2004,11:40–44.
- Jurban A, Lawm G, Kelly J, et al. Depressive disorders during weaning from prolonged mechanichal ventilation. Intensive Care Med 2010, 36:828-835.
- Jones C, Griffiths RD, Slater T, et al. Significant cognitive dysfunction in non-delirious patients identified during and persisting following critical illness. Intensive Care Med 2006, 32:923-926.
- Francis J, Kapoor WN. Delirium in hospitalized elderly. J Gen Intern Med 1990, 5:65–79.
- Marcantonio ER, Goldman L, Mangione CM, et al. A clinical prediction rule for delirium after elective noncardiac surgery. JAMA 1994, 271:134–139.
- Inouye SK, Rushing JT, Foreman MD, et al. Does delirium contribute to poor hospital outcomes? A three-site epidemiologic study. J Gen Intern Med 1998, 13:234–242.
- Murray AM, Levkoff SE, Wetle TT Acute delirium and functional decline in the hospitalized elderly patient. J Gerontol 1993, 48:181.
- O’Keeffe S, Lavan J The prognostic significance of delirium in older hospital patients. J Am Geriatr Soc 1997, 45:174–178.
- Francis J, Kapoor WN. Prognosis after hospital discharge of older medical patients with delirium. J Am Geriatr Soc 1992, 40:601–606.
- Bellelli G, Frisoni GB, Turco R, et al. Delirium superimposed on dementia predicts 12-month survival in elderly patients discharged from a postacute rehabilitation facility. J Gerontol A Biol Sci Med Sci 2007, 62:1306–1309.
- Ouimet S, Kavanagh BP, Gottfried SB, Skrobik Y. Incidence, risk factors and consequences of ICU delirium. Intensive Care Med 2007, 33:66–73.
- Ely EW, Gautam S, Margolin R, Francis J, et al. The impact of delirium in the intensive care unit on hospital length of stay. Intensive Care Med 2001, 27:1892–1900.
- Milbrandt EB, Deppen S, Harrison PL, et al. Costs associated with delirium in mechanically ventilated patients. Crit Care Med 2004,32:955–962.
- Jackson JC, Gordon SM, Hart RP, et al. The association between delirium and cognitive decline: a review of the empirical literature. Neuropsychol Rev 2004,14:87–98
- Rockwood K, Brown M, Merry H, et al Societal costs of vascular cognitive impairment in older adults. Stroke 2002,33:1605–1609.
- Aguero-Torres H, von Strauss E, Viitanen M, et al. (2001) Institutionalization in the elderly: the role of chronic diseases and dementia. Cross-sectional and longitudinal data from a populationbased study. J Clin Epidemiol 54:795–801.
- Meagher DJ, Trzepacz PT (2000) Motoric subtypes of delirium. Semin Clin Neuropsychiatry 5:75–85 22. Justic M (2000) Does “ICU psychosis” really exist? Crit Care Nurs 20:28–37
- Justic M Does “ICU psychosis” really exist? Crit Care Nurs 2000, 20:28–37.
- Sanders AB. Missed delirium in older emergency department patients: a quality-of-care problem. Ann Emerg Med 2002, 39:338–341.
- Hustey FM, Meldon SW. The prevalence and documentation of impaired mental status in elderly emergency department patients. Ann Emerg Med 2002, 39:248–253.
- Lonergan E, Luxenberg J, Sastre AA. Benzodiazepines for delirium. Cochrane library, 2009.
- Meagher DJ. Delirium: optimising management. BMJ 2001; 322: 144-9
- Skirrow P, Jones C, Griffiths RD, Kaney S. The impact of current media events on hallucinatory content: The experience of the intensive care unit (ICU) patient. British Journal of Clinical Psychology 2002;41:87-91.
- Cohen IL, Gallagher TJ, Pohlman AS, et al. Management of the agitated intensive care unit patient. Critical Care Medicine 2002 30(12)(Suppl): S97-S123.
- Kapur S, Remington G, Jones C et al High levels of Dopamine D2 receptor occupancy with lowdose haloperidol treatment: A PET study Am J Psychiatry 1996; 153 (7): 948-950
- Farde L, Nordstrom AL, Weisel FA et al Positron emission tomographic analysis of central D1 and D2 dopamine receptor occupancy in patients treated with classical neuroleptics and clozapine: Relation to extrapyramidal side effects Arch Gen Psychiatry 1992; 49: 538-544
- Brown TM. Drug-induced delirium. Sem Clin Neuropsychiatry 2000; 5: 113-24.
- Practice guideline for the treatment of patients with delirium Am J Psychiatry 1999; 156: 1-20
- Seneff MG, Mathews RA Use of haloperidol infusions to control delirium in critically ill adults Ann Pharmacother 1995; 29: 690-693
- Ray WA, Chung CP, Murray KT,et al. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med. 2009;360:225–35.
- Schneider LS, Dagerman KS, Insel P. Risk of death with atypical antipsychotic drug treatment for dementia: meta-analysis of randomized placebo-controlled trials. JAMA. 2005;294:1934–43.
- Wang PS, Schneeweiss S, Avorn J, et al. Risk of death in elderly users of conventional vs. atypical antipsychotic medications. N Engl J Med. 2005;353:2335–41.
- Milbrandt EB, Kersten A, Kong L et al Haloperidol use is associated with lower hospital mortality in mechanically ventilated patients Crit Care Med 2005; 33(1): 226 – 229