Оригинал статьи ICM Covid -19.pdf
Перевод статьи COVID19+.pdf
Оригинал статьи ICM Covid -19.pdf
Перевод статьи COVID19+.pdf
Вопросы нейрохирургии им. Н.Н. Бурденко 2019, №6, с. 35-43 https://doi.org/10.17116/neiro20198306135
А.Г. НАЗАРЕНКО1, И.В. ИВАНОВ, А.Г. ЩЕСЮЛЬ2, В.Н. ШИМАНСКИЙ1, И.А. САВИН1, О.А. ГАДЖИЕВА1, О.Н. ЕРШОВА1, Н.М. МАТУЕВА1, Н.А. КОНОВАЛОВ1, М.А. ШУЛЬЦ1, Г.В. ДАНИЛОВ1, А.Д. СОСНИН1, А.И. БАРАНИЧ1, О.И. ШАРИПОВ1
Анестезиология и реаниматология 2019, №4, с. 43-49 https://doi.org/10.17116/anaesthesiology201904143
Захарова Н.Е., Данилов Г.В., Потапов А.А., Пронин И.Н., Александрова Е.В., Кравчук А.Д., Ошоров А.В., Сычев А.А., Полупан А.А., Савин И.А.
Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2019;83(4): 46‑55
Скачать статью pdf
Скачать статью pdf
В 1871 г. Н. Eppinge [1] впервые описал аневризму сосудов головного мозга у ребенка. Среди всех пациентов с аневризмами головного мозга только в 2,6% эта патология выявляется у детей [2]. Описаны анатомические и топографические особенности аневризм, возникающих в детском возрасте, которые отличают их от аналогичной патологии у взрослых, однако влияние этих особенностей на тяжесть аневризматического субарахноидального кровоизлияния (аСАК) и на клинические проявления острого периода изучено недостаточно [3—5].
В остром периоде разрыва интракраниальных аневризм состояние детей чаще оценивается как удовлетворительное: I—II стадия по шкале Hunt—Hess в 60—70% наблюдений [6—9]. Тяжелое течение аСАК, которое соответствует I—V стадиям по шкале Hunt—Hess, описано только в 30% случаев. При этом смертность детей с V стадией по шкале Hunt—Hess может достигать 82% [10].
У детей в остром периоде аСАК, так же как и у взрослых, описано развитие внутричерепной гипертензии (ВЧГ) и вазоспазма. При этом ВЧГ считается одной из ведущих причин летального исхода. Частота развития отсроченного ишемического повреждения мозга на фоне вазоспазма у детей ниже, чем у взрослых [10].
Тяжелое течение аСАК, сопровождающееся развитием ВЧГ и вазоспазма, требует агрессивной хирургической тактики и интенсивной терапии (ИТ). При этом основные принципы ИТ детей в остром периоде аСАК заимствованы из «взрослой» практики. Очевидно, что принципы терапии, эффективность которой доказана у взрослых, не могут безоговорочно использоваться у детей.
Подходы к лечению детей с интракраниальными аневризмами основаны на приводимых в литературе клинических случаях и описаниях небольших серий наблюдений. Отсутствуют исследования, позволяющие разработать доказательные подходы к интенсивной терапии в лечении детей с аСАК.
В связи с отсутствием рекомендаций по ведению детей с тяжелыми аСАК и крайне редкой частотой развития благоприятных исходов у таких пациентов мы приводим клиническое наблюдение аСАК из аневризмы средней мозговой артерии (СМА) с тяжелым течением (Hunt—Hess V) у девочки 8 лет.
Пациентка Э., 8 лет, поступила 24.09.15 в отделение реанимации Центра нейрохирургии им. Н.Н. Бурденко с диагнозом: аневризма бифуркации левой СМА. Рецидивирующее субарахноидально-паренхиматозное кровоизлияние с формированием гематомы в области левой сильвиевой щели. Fisher 4, V стадия по Hunt—Hess.
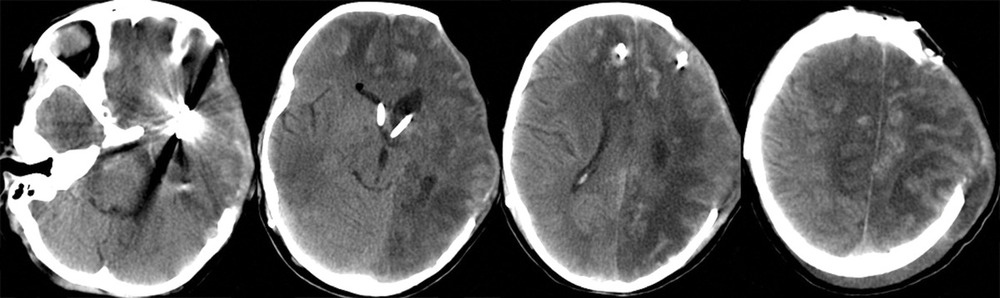
При поступлении на 2-е сутки после аСАК девочка находилась в коматозном состоянии: 4 балла по шкале комы Глазго. При неврологическом осмотре выявлялись мидриаз (D=S) и отсутствие фотореакции. В ответ на болевой стимул отмечались реакции по типу децеребрации. По данным компьютерной томографии (КТ) и КТ-ангиографии головного мозга были выявлены: аневризма левой СМА, субарахноидально-паренхиматозное кровоизлияние с формированием гематомы объемом около 30 см3 в области левой сильвиевой щели, латеральная дислокация срединных структур 6,5 мм, сдавление охватывающей цистерны (рис. 1).
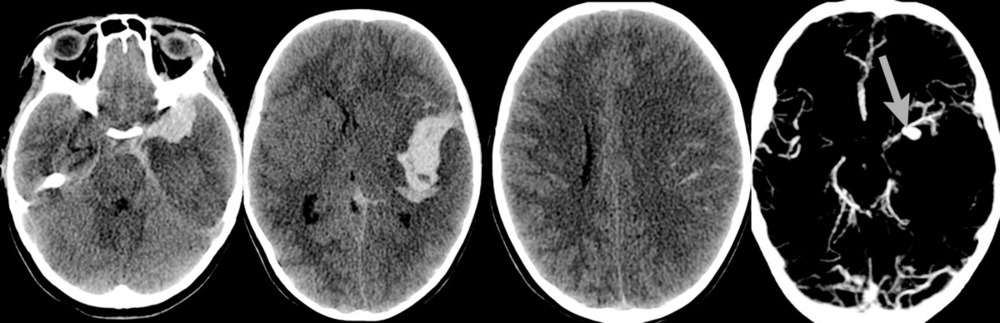
После экстренно проведенной коррекции ВЧГ (седация пропофолом, гиперосмолярная терапия, гипервентиляция) наблюдалась положительная динамика неврологической симптоматики в виде сужения зрачков и появления фотореакции с обеих сторон. В дальнейшем параметры искусственной вентиляции легких (ИВЛ) были подобраны так, чтобы обеспечить нормовентиляцию: PaCO2 в переделах 35—45 мм рт. ст. и PaO2 в пределах 100—110 мм рт. ст. Был начат инвазивный мониторинг артериального давления (АД), при этом системное АД без вазопрессорной поддержки составляло 100/60—110/70 мм рт.ст., ЧСС — 77—90 уд/мин. В связи с клинико-рентгенологической картиной отека мозга и дислокацией срединных структур мозга, согласно КТ, коматозным состоянием пациентки и наличием реакции на экстренные терапевтические манипуляции было принято решение об экстренном выполнении нейрохирургической операции. В течение полутора часов после поступления ребенка было выполнено нейрохирургическое вмешательство: клипирование аневризмы бифуркации левой СМА, удаление внутримозговой гематомы левой височной доли, наружная декомпрессия черепа слева. Операция была завершена установкой паренхиматозного датчика фирмы Codman в левую премоторную область для мониторинга внутричерепного давления (ВЧД) и контроля церебрального перфузионного давления (ЦПД). ВЧД при установке датчика составило 2 мм рт.ст. На следующий день после операции выполнена контрольная КТ головного мозга, по данным которой диффузный отек сохранялся (рис. 2).
На 2-е сутки после операции была предпринята попытка прекращения седации для оценки динамики неврологического статуса. На фоне прекращения седации наблюдался рост ВЧД с 12 до 25 мм рт.ст. В связи с этим седативная терапия была продолжена. Из-за прогнозируемой длительной ИВЛ выполнена трахеостомия. При транскраниальной допплерографии (ТКДГ) выявлено повышение линейной скорости кровотока (ЛСК): пиковая ЛСК по СМА слева составила 250 см/с, справа — 170 см/с. Эти данные позволили предположить развитие вазоспазма в СМА слева.
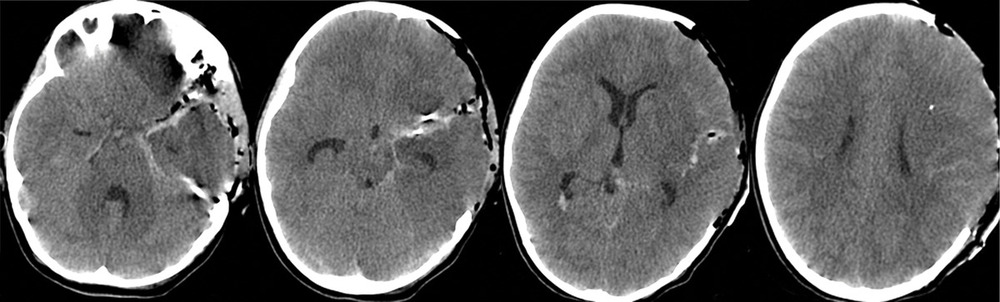
На 3-и сутки, несмотря на проводимую седацию и обезболивание, отмечалось устойчивое повышение ВЧД до 30 мм рт.ст. Гиперосмолярная терапия, гипервентиляция и углубление седации приводили лишь к кратковременному эффекту. Впоследствии развилась гипернатриемия — Na плазмы крови колебался в пределах 155—165 ммол/л. По данным ТКДГ, отмечалось нарастание скорости кровотока: пиковая ЛСК по СМА слева — 300—310 см/с, справа — 200—220 см/с. В связи с отрицательной динамикой состояния была выполнена КТ головного мозга (рис. 3),
при которой отмечены выраженный отек и формирование обширного очага ишемии в левом полушарии. Желудочковая система и базальные цистерны прослеживались. Для проведения дифференциальной диагностики вазоспазма и постдислокационных нарушений кровообращения была выполнена прямая ангиография, по результатам которой выраженный ангиоспазм в левом каротидном бассейне не был подтвержден (рис. 4).
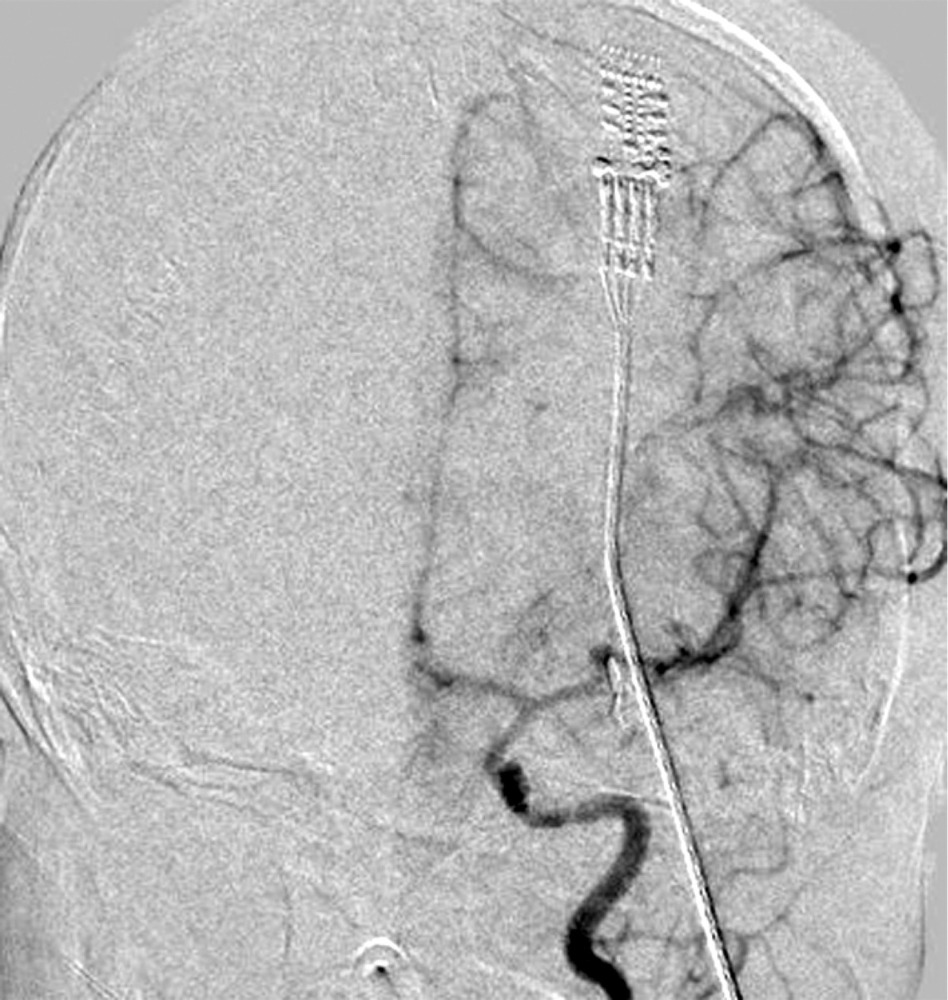
Учитывая нарастание ВЧД (эпизоды до 65 мм рт.ст.), несмотря на седацию и обезболивание, отсутствие резервов по применению гиперосмолярных растворов и гипервентиляции, была начата наружная гипотермия с целевой температурой тела в пределах 32—34 °С. Также для борьбы с ВЧГ в передний рог правого бокового желудочка был установлен наружный вентрикулярный дренаж (НВД). С целью обеспечения адекватного ЦПД (выше 40 мм рт.ст.) была начата инфузия норэпинефрина в дозе 0,05—0,1 мкг/кг/мин.
На 5—7-е сутки после операции отмечались развитие анизокории D<S и угнетение кашлевого рефлекса. ВЧД колебалось в диапазоне 30—60 мм рт.ст., ЦПД удавалось поддерживать на целевом уровне выше 40 мм рт.ст. Поддерживалась гипотермия 33 °C.
На 8-е сутки отмечалось нарастание отрицательной динамики в виде развития двустороннего мидриаза, угнетения всех сегментарных стволовых рефлексов, диффузного снижения мышечного тонуса. Сохранялась выраженная ВЧГ (ВЧД 30—65 мм рт.ст.). Дозы норэпинефрина варьировали и максимально достигали 0,5 мкг/кг/мин, что обеспечивало поддержание целевых параметров ЦПД более 40 мм рт.ст.
На 10-е сутки на фоне проводимой терапии появилась положительная динамика в виде нормализации размера левого зрачка, восстановления кашлевого рефлекса. Была прекращена управляемая гипотермия (в течение 24 ч проводилось согревание до нормотермии). ВЧД преимущественно оставалось в пределах нормы, с единичными в течение суток подъемами до 40 мм рт.ст. ЦПД соответствовало целевым параметрам.
На 13-е сутки сохранялась положительная динамика в неврологическом статусе: появились движения в левых конечностях в ответ на болевой стимул. ВЧД на фоне седации и гиперосмолярных растворов находилось в пределах 15—25 мм рт.ст. Была прекращена вазопрессорная поддержка.
На 18-е сутки после аСАК и операции пациентка начала приоткрывать глаза, появились спонтанные сгибательные движения в конечностях, оромандибулярная активность. Состояние расценивалось как вегетативное. ВЧД на фоне открытого НВД было нормальным — 11—17 мм рт.ст. При перекрывании НВД ВЧД повышалось до 25—30 мм рт.ст.
Учитывая зависимость пациентки от НВД, было выполнено вентрикуло-перитонеальное шунтирование (ВПШ) справа. Мониторинг ВЧД был прекращен на 20-е сутки после аСАК.
По данным КТ на 22-е сутки после аСАК отмечались разобщение желудочковой системы и расширение левого бокового желудочка. Был установлен НВД в левый боковой желудочек. В последующем было выполнено ВПШ справа с предварительной вентрикулостомией правого и левого желудочков.
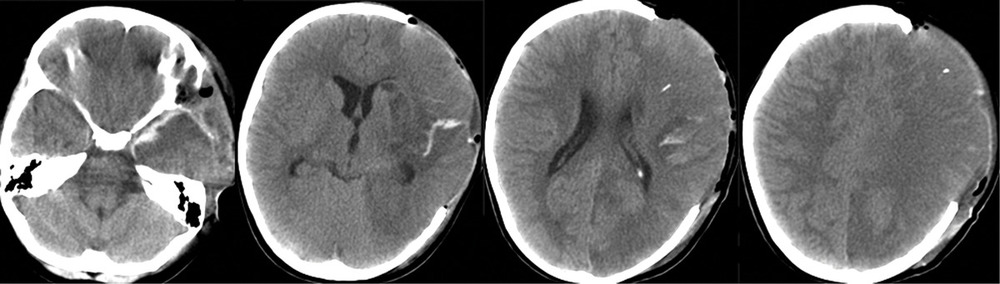
На 28-е сутки после аСАК отмечено выполнение простых инструкций, и пациентка была переведена на спонтанное дыхание через трахеостомическую трубку. При К.Т. в левом полушарии головного мозга отмечались выраженные постишемические нарушения. Гидроцефалии на фоне ВПШ не было (рис. 5).
Спустя 30 сут девочка была переведена из реанимации в нейрохирургическое отделение для дальнейшей терапии. На 68-е сутки после операции состояние пациентки соответствовало 3 баллам по ШИГ, и она была переведена в реабилитационный центр.
Через несколько месяцев в другом нейрохирургическом стационаре проведены краниопластика в левой лобно-теменно-височной области и удаление ВПШ в связи с его дисфункцией.
Через 2 года после аСАК, несмотря на выраженные кистозно-глиозные изменения в левом полушарии (рис. 6),
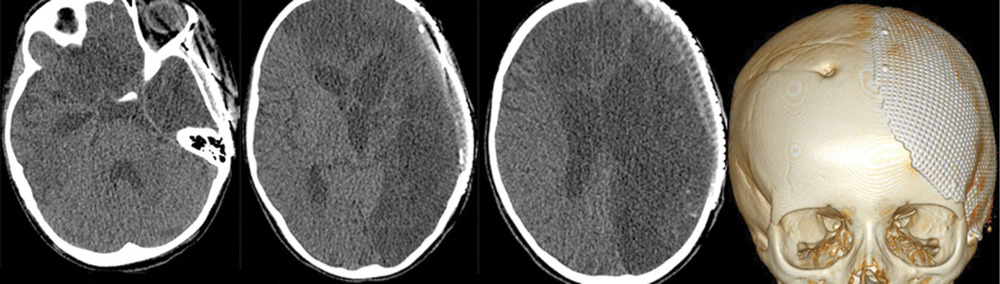
девочка практически не имеет ограничений в повседневной двигательной активности, самостоятельно ходит, разговаривает, посещает школу. Из очаговой неврологической симптоматики сохраняется правосторонний гемипарез до 4 баллов. К настоящему времени состояние пациентки соответствует ШИГ IV.
Тяжелое аСАК (IV—V стадия по шкале Hunt—Hess) у детей встречается нечасто. Так, в обзоре А. Sorteberg и соавт. [10] из 1165 случаев аСАК у педиатрических пациентов только в 35% было описано тяжелое течение, соответствующее V стадии. Частота летальных исходов в этой группе составила 82%, и только в 13% удалось достичь относительно благоприятного исхода по ШИГ (ШИГ III) (см. таблицу).
![Частота функциональных исходов по ШИГ у детей с интракраниальными аневризмами в зависимости от тяжести состояния при поступлении (A. Sorteberg и D. Dahlberg [10])](/uploads/attachment/file/959/voprosy_neirokhirurgii_2018_03_08_tab1.png)
Как видно из таблицы, ШИГ III является наиболее благоприятным исходом аСАК у детей с первоначальной тяжестью состояния V по шкале Hunt—Hess. Наше клиническое наблюдение демонстрирует наилучший результат лечения из приводимых в литературе. Что этому способствовало?
Пациентка поступила в коматозном состоянии с угнетением сегментарных стволовых рефлексов уровня среднего мозга и моста с признаками дислокации срединных структур головного мозга, в условиях ИВЛ, замещающей полностью спонтанное дыхание. Однако после проведенной осмотерапии и гипервентиляции состояние пациентки улучшилось. Учитывая, что ствол мозга еще не был необратимо поврежден, было принято решение об экстренном нейрохирургическом вмешательстве. Было выполнено клипирование аневризмы, удаление внутримозговой гематомы и декомпрессивная гемикраниоэктомия. Мы не будем детально останавливаться на особенностях нейрохирургических вмешательств у детей с САК, этот аспект лечения подробно описали Ш.Ш. Элиава и соавт. [2]. Однако следует отметить, что при отсутствии своевременной и адекватной нейрохирургической тактики достигнуть благоприятного исхода у этой пациентки было бы невозможно. Гемикраниоэктомия и НВД внесли значимый вклад в борьбу с выраженной ВЧГ. Клипирование аневризмы позволило проводить в дальнейшем гипердинамическую терапию, поддерживать целевые параметры ЦПД на фоне эпизодов выраженной ВЧГ. Кроме того, строгое соблюдение разработанных в Центре протоколов профилактики низкомиальных инфекций позволило не допустить развития менингита в послеоперационном периоде.
Важным аспектом эффективной ИТ явился расширенный нейромониторинг. Получая в режиме реального времени показатели ВЧД, было возможно своевременно корректировать ИТ.
В настоящее время нет протоколов ИТ у детей с аСАК, разработанных с позиций доказательной медицины. Основным фактором вторичного повреждения мозга в приводимом наблюдении являлась выраженная и устойчивая ВЧГ. В основном принципы ИТ, направленные на предупреждение и коррекцию ВЧГ, были заимствованы из практики лечения взрослых больных и протоколов лечения детей с тяжелой ЧМТ. Они включали декомпрессивную трепанацию, наружное вентрикулярное дренирование, седацию, осмотерапию, гипотермию и т. д. Однако, несмотря на все проводимые мероприятия, у пациентки прогрессировала ВЧГ. Опираясь на протокол лечения детей с тяжелой ЧМТ [11], было принято решение строго поддерживать ЦПД не ниже 40 мм рт.ст., чтобы не допустить ишемии мозга на фоне выраженной ВЧГ. Это было возможно осуществить только в условиях непрерывного инвазивного мониторинга среднего АД и ВЧД [13—17]. Эпизодически ВЧД достигало 65 мм рт.ст. При этом требуемое среднее АД в диапазоне 80—90 мм рт.ст. достигалось увеличением дозы непрерывно вводимого симпатомиметика (норэпинефрина) и наращиванием темпа внутривенной инфузии (коллоидные и кристаллоидные растворы). Подобная упорная и агрессивная тактика ИТ, направленная на поддержание оптимального ЦПД, привела к стабилизации и последующему улучшению состояния девочки на 10—21-е сутки после аСАК.
Одной из наиболее значимых причин развития отсроченной ишемии мозга и неблагоприятного исхода у пациентов взрослого возраста с аСАК является вазоспазм. У детей ситуация обстоит иначе. Ангиографический вазоспазм является нередким событием среди пациентов детского возраста. Так, J. Ostergaard и B. Voldby [6] показали, что, по данным ангиографии, вазоспазм у детей развивается в 53% случаев аСАК, но при этом клинические проявления вазоспазма в виде появления дополнительного неврологического дефицита наблюдаются крайне редко. Эти данные позволяют считать, что вазоспазм, который приводит к развитию отсроченной ишемии головного мозга у взрослых, не столь опасен для детей с аСАК. Возможным объяснением подобной толерантности может быть хорошо развитый коллатеральный кровоток [5]. В одной из работ показано, что среди 17 детей с ангиографическим вазоспазмом только у 3 пациентов отмечались клинические проявления, и именно у них наблюдалось слабое развитие коллатерального кровотока [18].
В описанном нами случае возникновение и динамика вазоспазма изначально оценивались с помощью ТКДГ. Начиная со 2-х суток после разрыва аневризмы было отмечено нарастание ЛСК. На 3-и сутки после нейрохирургического вмешательства при повторной КТ была выявлена зона постишемического отека в левом полушарии. Для верификации причин развития ишемии была выполнена прямая ангиография, по данным которой спазм сосудов не был выражен. Вероятно, формирование ишемического очага было следствием дислокационного синдрома.
Должно ли нарастание ЛСК заставить клинициста принимать меры по целенаправленному лечению ангиоспазма у детей? Применение у детей критериев вазоспазма, принятых у взрослых пациентов при аСАК, ведет к значимой гипердиагностике вазоспазма. По данным Р. Moftakhar и соавт. [18], из 12 детей с диагностированным по ТКДГ ангиоспазмом по критериям взрослого возраста лишь у 1 пациента спазм подтвердился при ангиографии, при этом клинических проявлений не наблюдалось ни у одного из детей.
В представленном клиническом наблюдении, несмотря на крайне тяжелое состояние пациентки при поступлении в Центр нейрохирургии им. Н.Н. Бурденко, оцененное как V стадия по шкале Hunt—Hess, исход заболевания оказался относительно благоприятным. Спустя 2 года после разрыва аневризмы пациентка разговаривает, ходит с незначительной поддержкой, продолжает обучение в школе.
Эффективность лечения определили своевременное экстренное нейрохирургическое вмешательство, что облегчило борьбу с ВЧГ, и адекватная ИТ в виде расширенного нейромониторинга с непрерывным измерением ВЧД, что позволяло использовать весь комплекс мероприятий, направленных на своевременную борьбу с ВЧГ.
Дополнив диагностический комплекс прямой ангиографией, клиницисты смогли исключить выраженный вазоспазм как фактор вторичного повреждения мозга.
Благоприятный исход (ШИГ IV) после столь тяжелого течения аневризматического САК говорит о том, что абсолютных противопоказаний для нейрохирургического лечения детей с аневризмами головного мозга не существует. Адекватная И.Т. возможна только в условиях расширенного нейромониторинга. Даже при условии длительной ВЧГ возможно восстановление всех витальных функций, а дальнейшая реабилитация может вернуть пациента к полноценной жизни.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: asichev@mail.ru
Аневризмы и аневризматические кровоизлияния — редкая патология для детского возраста. Представленные публикации по теме малочисленны. Данная работа — еще один клинический случай в «общую копилку» знаний по этой проблеме.
Авторы продемонстрировали успешное лечение ребенка 8 лет с тяжелым аневризматическим САК (V стадия по шкале Ханта—Хесса). Состояние ребенка сопровождалось фармакорезистентной внутричерепной гипертензией. Важно подчеркнуть, что вероятность фатального исхода была чрезвычайно высокой.
Этот случай показал, что у детей при сочетании своевременной адекватной хирургической тактики и дальнейшей интенсивной терапии в условиях нейромониторинга возможен хороший исход.
Не могу согласиться с формулировкой «агрессивная хирургическая тактика» — хирургия не может быть «агрессивной» или «неагрессивной», особенно в условиях неотложной специализированной помощи. Обсуждать следует только своевременность и адекватность объема хирургического лечения. В данном случае и первое, и второе имели место.
Ж.Б. Семенова (Москва)