Ауторегуляция мозгового кровотока (АМК) представляет собой защитный механизм, направленный на поддержание мозгового кровотока в ответ на изменения церебрального перфузионного давления (ЦПД) и цереброваскулярной резистентности (ЦВР) [1]. Термин был предложен N. Lassen в 1959 г. [2]. При этом ЦПД представляет собой разность между средним артериальным давлением и внутричерепным давлением (ВЧД) и обратно пропорционально ЦВР. ЦВР в свою очередь представляет суммарное сосудистое сопротивление, в том числе артериол мягкой мозговой оболочки и пенетрирующих прекапиллярных артериол мозга [3]. Скорость мозгового кровотока прямо пропорциональна ЦПД и обратно пропорциональна ЦВР.
Существует ряд механизмов, участвующих в регуляции поддержания уровня мозгового кровотока (норма — 50 мл/100 г/мин): 1) метаболические (pH крови, баланс растворенных в крови CO2/O2, оксид азота, аденозин, продукты функционирования астроцитов и нейронов) [4, 5]; 2) миогенные (эффект Остроумова—Бейлиса — реакция со стороны гладкомышечного слоя артерий в виде сокращения при повышении АД и расслабления при его снижении); 3) периферические (или системные) (активность симпато-адреналовой системы, каротидных клубочков, температура, эндотелиальные факторы); 4) нейрогенные (сосудодвигательный центр, центры регуляции активности симпатической системы и, возможно, ряд других структур мозга). Звенья последних наименее изучены.
Все механизмы АМК обеспечивают поддержание церебральной перфузии при колебании АД в пределах 60—70 и 170—180 мм рт.ст. При повышении или снижении АД за пределы данного диапазона возникает срыв ауторегуляции — состояние, при котором мозговой кровоток пассивно зависит от системного АД, а ВЧД становится напрямую зависимым от артериального давления. Данное состояние опасно как развитием ишемии, так и развитием синдрома «роскошной перфузии» («luxury perfusion syndrome», реактивной гиперемии), ассоциированного с высоким риском вторичных ишемических или геморрагических осложнений.
АМК часто нарушается в остром периоде тяжелой черепно-мозговой травмы (тЧМТ), протекающей с нестабильностью гемодинамики и ассоциирована с неблагоприятным исходом. Оценка состояния АМК в настоящее время служит основным объективным ориентиром для мониторинга и коррекции консервативного лечения и принятия решения о нейрохирургическом вмешательстве в остром периоде тЧМТ [6]. Для пациентов с нарушенной ауторегуляцией вследствие тЧМТ достижение рекомендуемого уровня ЦПД (не ниже 70 мм рт.ст.) может быть связано с мозговой гиперемией, предрасполагающей к формированию внутричерепной гипертензии, отеку и внутримозговым кровоизлияниям [6]. Поэтому, согласно последним рекомендациям, для данной группы пациентов необходимая граница ЦПД снижена до 60 мм рт.ст. [7]. Недавние исследования [3] показали, что поддержание уровня ЦПД ниже 50—60 мм рт.ст. ассоциировано с большим количеством положительных исходов, в то время как ЦПД более 70—80 мм рт.ст. чаще приводит к неблагоприятным исходам у пациентов с нарушенной АМК.
В классических работах N. Lundberg [8] выделены три вида спонтанных колебаний ВЧД: А-волны (плато), В- и С-волны. В последующих исследованиях было показано, что плато-волны отражают церебральную вазодилатацию, которая приводит к увеличению объемного мозгового кровотока и, как следствие, повышению ВЧД [9]. В настоящее время на анализе волновых колебаний артериального и внутричерепного давления основан один из наиболее надежных и безопасных методов непрерывной оценки ауторегуляции состояния мозговых сосудов в остром периоде тЧМТ — мониторинг коэффициента реактивности мозговых сосудов (pressure reactivity index — PRx). PRx представляет собой коэффициент корреляции между медленноволновыми колебаниями АД и ВЧД [10, 11]. Показано, что плато-волны ВЧД при тЧМТ чаще регистрируются при сохранной ауторегуляции мозговых сосудов. В момент формирования плато-волн развивается максимальная вазодилатация артериол и ауторегуляция утрачивается, что регистрируется ростом PRx [12].
Ранее в экспериментальных исследованиях [13, 14] было показано, что повреждение определенных структур ствола мозга и гипоталамуса сопровождается развитием отека головного мозга. Электростимуляция отдельных структур ствола инициирует процессы, приводящие к церебральной вазодилатации и увеличению объемного мозгового кровотока [15, 16]. Предполагается, что ствол мозга может быть напрямую вовлечен в генерацию волн, характерных для внутричерепной гипертензии, однако анатомические пути и механизмы этого влияния до сих пор недостаточно изучены. В ряде экспериментальных работ показано влияние стимуляции отдельных структур ствола (в том числе голубоватого места — locus coeruleus) ретикулярной формации продолговатого мозга и полушарных структур мозга (в частности, передней поясной извилины и передних отделов гипоталамуса) на изменения ВЧД [17]. Также ранее было показано, что повреждение стволовых структур и лобных долей при ЧМТ может приводить к изменению активности симпатической нервной системы, влияющей на тонус артерий [18].
Особенностью ДАП является преимущественное повреждение подкорковых и стволовых структур мозга, участвующих в поддержании жизненно важных функций, в том числе регуляции церебрального сосудистого тонуса и АМК.
Цель настоящей работы — выявить анатомические повреждения глубинных структур мозга, оказывающие влияние на степень и длительность нарушений АМК в остром периоде тяжелого ДАП.
Материал и методы
В анализ включены 37 пациентов с тЧМТ (3—8 баллов по шкале комы Глазго), находившихся на лечении в отделении реанимации НМИЦ нейрохирургии им. Н.Н. Бурденко в период с 2009 по 2014 г. Критериям включения соответствовали пациенты, которые по клиническим показаниям требовали мониторинга АД, ВЧД, ЦПД и у которых при выполнении МРТ головного мозга были выявлены признаки ДАП. Данные мониторинга сохранялись, анализировались и рассчитывались с помощью программного обеспечения ICM Plus. Всего в анализ включены 23 мужчины, 12 женщин, средний возраст которых составил 28±12,4 года. Семи пациентам данной группы была проведена декомпрессивная трепанация черепа в связи с диффузным отеком головного мозга.
В отделении реанимации и интенсивной терапии больным проводились ИВЛ, РаСО2 поддерживалось на уровне 35—45 мм рт.ст., РаО2 — не ниже 100 мм рт.ст., проводилась седация, аналгезия (пропофол 1—3 мг/кг/ч или мидазолам 10—30 мкг/кг/ч, фентанил 1—2 мкг/кг/ч). ЦПД поддерживалось выше 60 мм рт.ст. При ВЧД выше 20 мм рт.ст. использовали болюсное введение 15% маннитола (0,25—1 г/кг) или Гиперхаеса в дозе 2—3 мл/кг.
Для оценки глубины комы использовалась шкала комы Глазго (ШКГ) [19, 20]. Исходы ЧМТ оценивали по шкале исходов Глазго (ШИГ) [20, 21]. Повреждения мозга при ДАП оценивались по классификации, основанной на данных МРТ [22]. Локализация и уровень повреждения мозга оценивались по МРТ-классификации, предложенной Н.Е. Захаровой и соавт. [23].
Всем пациентам проводился мониторинг ВЧД согласно международным рекомендациям и протоколу ассоциации нейрохирургов РФ [7, 24]. Мониторинг ВЧД проводился с помощью монитора ICP Express Monitor Codman и датчика Codman MicroSensor («Jonson&Jonson Professional, Inc.», Raynham, США). Датчик ВЧД имплантировался в белое вещество мозга через трефинационное отверстие в проекции точки Кохера в премоторную зону субдоминантного полушария. Оценка АМК выполнялась с помощью мониторинга показателя реактивности мозговых сосудов PRx [10]. Длительность мониторинга PRx в среднем составила 7 сут. Оценивали также соотношение длительности периода нарушенной ауторегуляции к общей продолжительности мониторинга этого параметра.
Мониторинг АД проводился с помощью прямого измерения через артериальный катетер, установленный в лучевой, бедренной артериях или в тыльной артерии стопы.
На основании расчета среднего коэффициента PRx за весь период наблюдения при мониторировании ВЧД и ЦПД было выделено две группы пациентов:
1-я группа — с сохранной АМК — PRx [–1; 0];
2-я группа — с частично или полностью утраченной АМК — PRx (0; 1].
Характеристика пациентов каждой группы представлена в табл. 1.
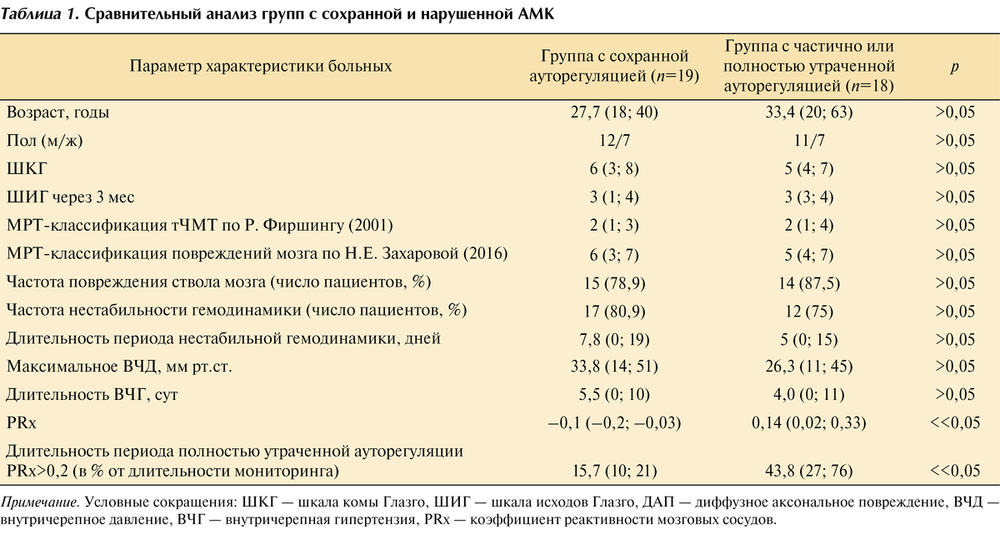
1-ю группу составили 19 пациентов. У 16 (84,2%) из них причиной травмы было ДТП. У 15 (78,9%) пациентов при проведении МРТ было диагностировано повреждение ствола головного мозга. 2-я группа представлена 18 пациентами. У 15 из них причиной травмы было ДТП. Семи пациентам проведена декомпрессивная трепанация в связи с диффузным отеком головного мозга. У 15 (83,3%) пациентов этой группы при проведении МРТ визуализировалось повреждение ствола головного мозга.
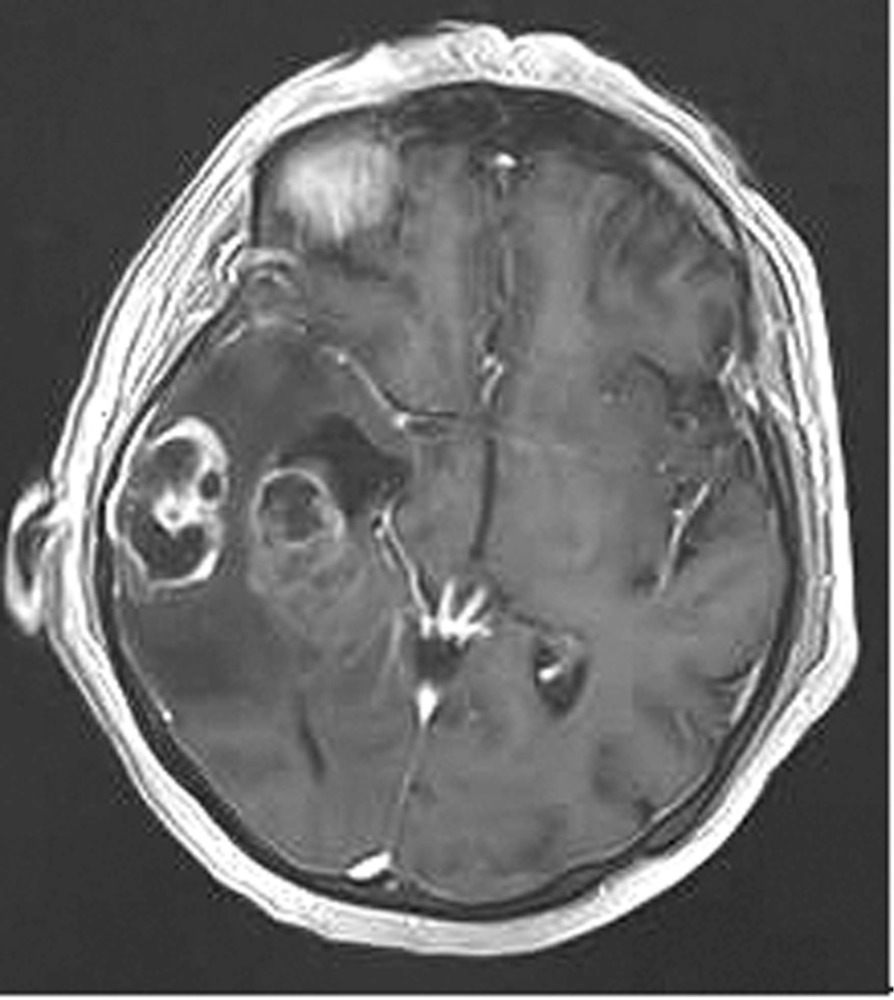
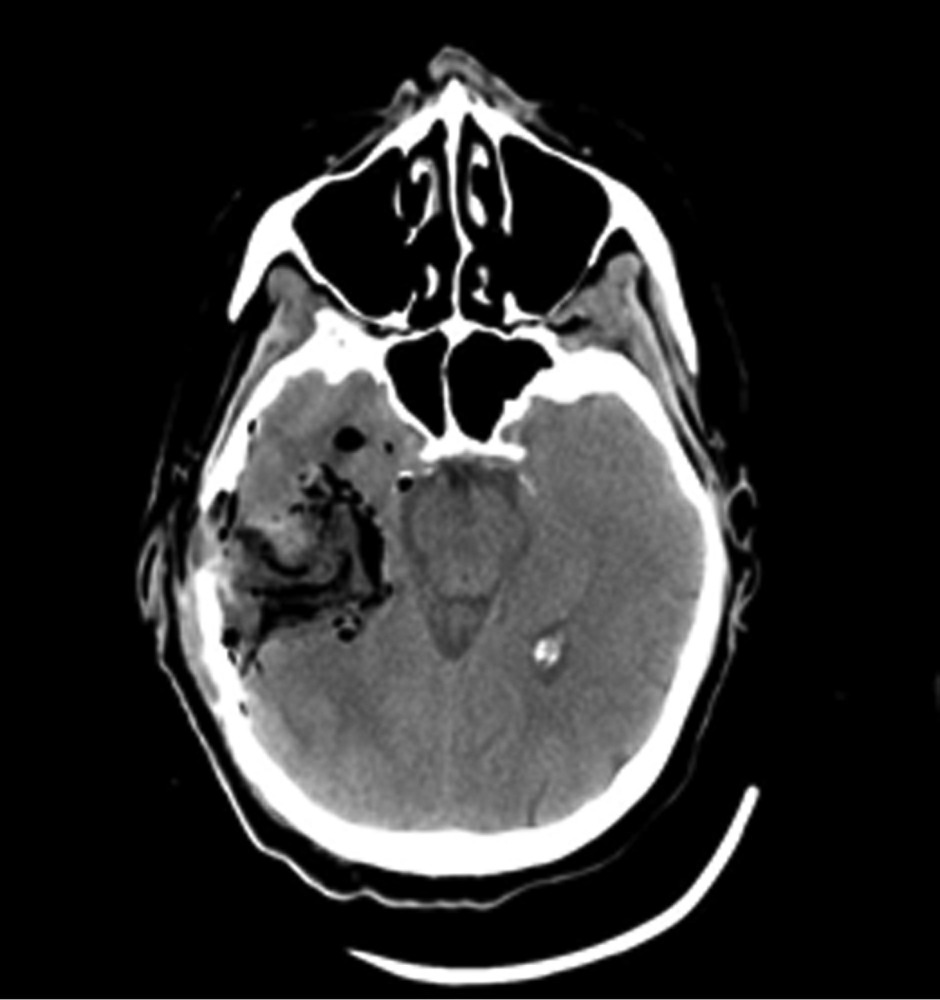
Методы нейровизуализации. МРТ головного мозга проводилось на 3 Т томографе GE в стандартных режимах (T1, T2, FLAIR) и режимах SWI/Т2* GRE, DWI, что позволило оценить как ишемические, так и мелкие геморрагические очаговые повреждения. У каждого пациента, по данным МРТ, было оценено повреждение отдельных подкорковых структур и зон ствола головного мозга, являющихся проекциями основных нейромедиаторных систем мозга (рис. 1),
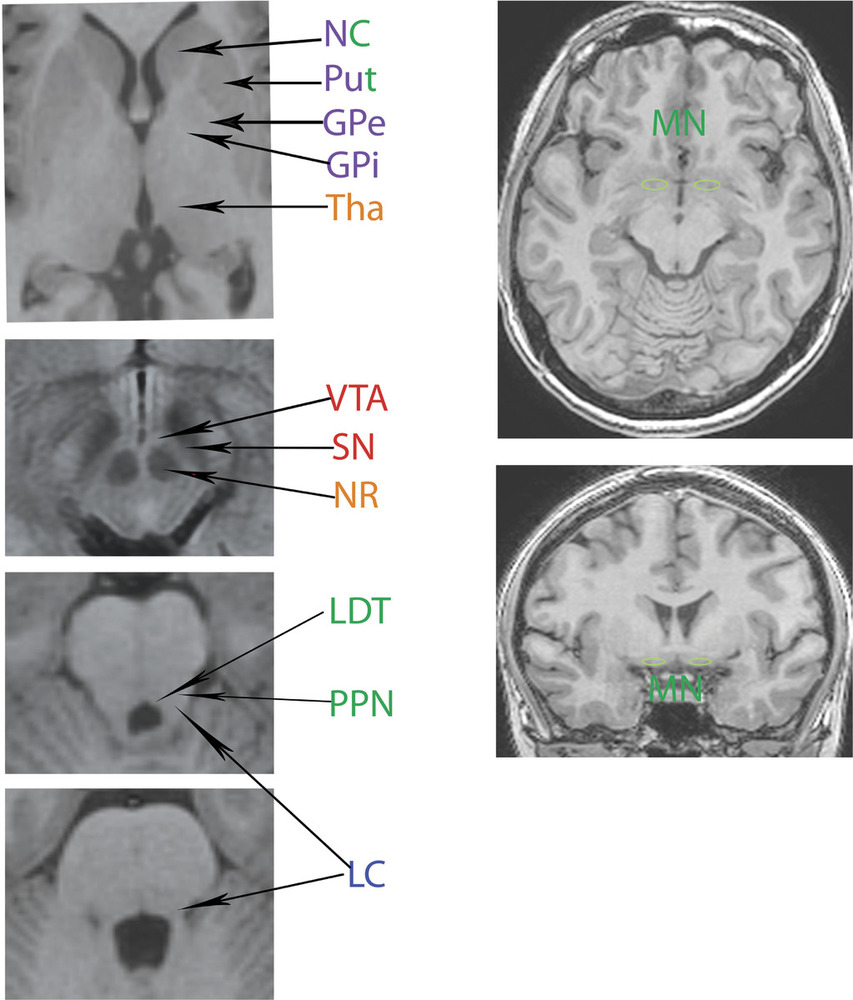
а также области поражения лобных долей (медиобазальные, полюсные и дорзолатеральные отделы). Статистические методы. Обработка данных проведена в пакете программ Statistica 8.0. («StatSoft Inc», США). Во всех случаях для статистической оценки были использованы непараметрические критерии. Для анализа качественных признаков применялся критерий Фишера (F), для оценки влияния анатомических факторов на риск развития нестабильной гемодинамики рассчитывались отношения шансов, чувствительность и специфичность каждого фактора. Результаты считались статистически значимыми при р<0,05.
Результаты
Данные анализа МРТ показали, что у всех пациентов анализируемой выборки отмечались признаки диффузного повреждения мозга с вовлечением полушарных и у 29 (78,4%) из 37 пациентов — стволовых структур. Вместе с тем небольшая численность пациентов в группах с сохранной и нарушенной ауторегуляцией не позволила выявить достоверные отличия в исходах по ШИГ тяжести травмы по ШКГ. Группы не отличались между собой по половозрастным характеристикам. Локализация и глубина повреждений мозга, оцененных по классификациям Р. Фиршинга и соавт. [22] и Н.Е. Захаровой и соавт. [23], также значимо не различалась между группами сравнения (см. табл. 1).
1. Распространенность повреждения стволовых и подкорковых структур мозга при нарушенной АМК
Далее был проведен статистический анализ частоты встречаемости одно- или двустороннего повреждения каждой структуры мозга у пациентов с нарушенной (2-я группа) и сохранной (1-я группа) ауторегуляцией (табл. 2).
Статистический анализ данных показал, что у пациентов с травматическим повреждением мозга, сопровождающимся нарушениями АМК в остром периоде травмы, в целом повреждения ствола отмечались несколько чаще, чем в группе пациентов с нормальной ауторегуляцией. Среди изученных стволовых структур значительно чаще (р=0,02) у пациентов 2-й группы отмечалось структурное повреждение черной субстанции среднего мозга — структуры, являющейся источником дофаминергических проекций для неостриатума, поясной коры, обонятельных ядер, заднего гипоталамуса и миндалин мозга. Отношение шансов составило 5,333 (95% ДИ 1,252; 29,346), чувствительность 62,5% и специфичность 76,2%. Также выявлено более частое повреждение холинергической структуры – области ядра Мейнерта у пациентов с нарушенной ауторегуляцией (р=0,01), причем одно- или двустороннее повреждение этой области мозга имело достаточно высокую специфичность (81%) для пациентов данной группы. Дополнительно была оценена частота встречаемости сочетанного повреждения черной субстанции и ядра Мейнерта, которая значимо преобладала в группе с нарушенной ауторегуляцией (р=0,02). Отношение шансов составило 7,39 (95% ДИ 1,043; 65,37), чувствительность 43,8% и специфичность 90,5%.
Таким образом, анализ показал, что нарушение ауторегуляции мозгового кровотока у пациентов с ДАП головного мозга часто ассоциировано с наличием первичного повреждения черной субстанции, области ядра Мейнерта и их сочетанием (рис. 2).
2. Распространенность повреждения подкорковых и стволовых структур мозга при длительном нарушении ауторегуляции
Для анализа влияния повреждения подкорковых и стволовых структур мозга на параметр ауторегуляции кровотока (PRx) пациенты были разделены на три примерно равные по численности группы в зависимости от длительности периода утраченной ауторегуляции (PRx>0,2) относительно всего времени измерения: 1) менее 20% времени (n=17); 2) 20—34% времени (n=10); 3) 35% времени и более (n=10). Результаты данного анализа представлены в табл. 3.
Выявлено, что у пациентов с утраченной ауторегуляцией более 35% времени измерения несколько чаще присутствовало повреждение ствола. В этой группе пациентов значительно чаще встречались повреждения черной субстанции (р=0,05). Отношение шансов составило 5,6 (95% ДИ 0,785; 45,938), чувствительность и специфичность составили 70 и 70,6% соответственно. Также в данной группе отмечено более частое повреждение области ядра Мейнерта (р=0,04). Отношение шансов составило 7,6 (95% ДИ 1,006; 68,466), чувствительность и специфичность составили 70 и 76,5% соответственно.
Согласно результатам данного анализа, сохранились значимые различия в частоте повреждения черной субстанции, области ядра Мейнерта и их сочетания между крайними группами (при длительности нарушенной ауторегуляции менее 20% и более 35% времени измерения). Таким образом, наличие первичного повреждения ствола в области черной субстанции и базальных отделов переднего мозга (область ядра Мейнерта) вносит существенный вклад в нарушение механизмов АМК.
Обсуждение
Предложенная нами гипотеза о влиянии определенных нейромедиаторных структур мозга в качестве центральных звеньев на АМК при тяжелой травме мозга ранее не была освещена в литературе. Полученные нами данные на модели ДАП могут быть объяснены накопленными ранее результатами изучения других заболеваний мозга человека (главным образом, нейродегенеративных) и предшествовавшими экспериментальными работами.
В настоящее время доказано, что многие нейромедиаторные системы могут оказывать влияние на кровоток посредством рецепторов, находящихся на капиллярах или периваскулярной глии. Такие эффекты, в частности, показаны для дофамина, у которого существует два типа рецепторов: D1- и D2-подобные рецепторы, первые из которых обладают вазорелаксирующим, а вторые — вазоконстрикторным эффектами. Дофамин у человека оказывает сужающее действие на крупные мозговые артерии и тем самым увеличивает линейную скорость мозгового кровотока [26].
Черная субстанция функционально относится к экстрапирамидной системе, поскольку участвует в регуляции мышечного тонуса при обеспечении двигательных функций. Наименее известны и изучены анатомические пути, посредством которых она влияет на вегетативные функции: дыхание, сердечную деятельность и тонус сосудов. Черная субстанция содержит два вида нейронов, одни из которых используют дофамин (pars compacta), а другие (pars reticulata) — глутамат. В ряде экспериментальных работ показано, что электрическая стимуляция pars compacta черной субстанции вызывает тахикардию и повышение артериального давления [25, 27—29]. Подобные данные указывают на то, что дофаминергические нейроны черной субстанции активируют центральный путь кардиоваскулярного депрессорного центра, посредством которого происходит ингибирование симпатических волокон, вызывающих сужение артерий и учащение сердцебиения.
Дофаминергические нейроны черной субстанции посылают проекции к системе базальных отделов переднего мозга, получившей название «расширенной миндалины». «Расширенная миндалина» тесно связана со структурами переднего мозга и ствола, вовлеченными в регуляцию сердечно-сосудистой системы [29, 30]. Стимуляция ее структур так же, как и стимуляция черной субстанции, приводит к подавлению кардиоваскулярных реакций [31, 32], что позволяет объединить их в единую регуляторную систему. Ранее проведенные исследования показали, что активность дофаминергических нейронов черной субстанции может регулироваться артериальными барорецепторами [33, 34]. Денервация барорецепторов приводит к снижению продукции и высвобождения дофамина в стриатум. Эти данные указывают на важный факт, что дофаминергические нейроны черной субстанции могут явиться частью длинного центрального барорецепторного рефлекторного пути, регулирующего уровень АД [35].
Существуют доказательства, что холинергические нейроны также участвуют в регуляции регионального мозгового кровотока [36, 37], причем этот механизм регуляции не зависит от регионарного метаболизма и системного А.Д. Активация холинергических волокон ядра Мейнерта и септального комплекса приводит к высвобождению ацетилхолина в коре и гиппокампе, что провоцирует увеличение мозгового кровотока в данных структурах. Диффузное увеличение кровотока в коре во время ходьбы ассоциировано с возбуждением вазодилатирующей системы базального ядра Мейнерта [36]. Активация холинергических нейронов базальных отделов переднего мозга может вносить вклад в повышение ВЧД и формирование плато-волн за счет вазодилатации [17].
Известно, что при ряде нейродегенеративных заболеваний головного мозга (болезнь Паркинсона, мультисистемная атрофия) также отмечаются нарушения ауторегуляции, что связывается с вегетативной дисфункцией [38]. Однако каждое звено вегетативной системы имеет свое представительство в ЦНС, в частности в стволе головного мозга. Клинической моделью для понимания роли черной субстанции в регуляции кровотока является болезнь Паркинсона — заболевание, характеризующееся прогрессирующей утратой дофаминергических нейронов черной субстанции. Экспериментальные работы, моделирующие данное заболевание, указывают на ослабление симпатического компонента регуляции АД и сердечного ритма при дегенерации черной субстанции [39].
Таким образом, в настоящей работе показано, что повреждение дофаминергической структуры черной субстанции и холинергической структуры области ядра Мейнерта у пациентов с ДАП ассоциировано с более выраженным и длительным нарушением ауторегуляции мозгового кровотока. Полученные данные указывают на существование у человека нейрогенных механизмов регуляции тонуса мозговых сосудов, вносящих вклад в изменение ВЧД. Повреждение этих регуляторных звеньев в результате травмы сопряжено с более тяжелым и длительным периодом нарушенной ауторегуляции мозгового кровотока, что может потребовать более продолжительного мониторинга и коррекции ВЧД.
Результаты работы показывают наличие различных паттернов повреждения мозга у пациентов с нарушенными и сохранными механизмами церебральной ауторегуляции при одинаковой тяжести и клинической форме ЧМТ. Полученные нами данные, с клинической стороны, косвенно подтверждают результаты ранее проведенных экспериментальных исследований относительно наличия прямых нейрональных механизмов регуляции тонуса сосудов. Однако эти данные следует интерпретировать с осторожностью, они являются предварительными и лишь приоткрывают завесу сложных механизмов регуляции мозгового кровотока при острой патологии мозга. Безусловно, необходимы дальнейшие, более развернутые исследования в данном направлении, в том числе для идентификации всех звеньев нейрональной регуляторной системы.
Работа поддержана грантом РФФИ № 16−04−01472.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: Ealexandrova.nsi@gmail.com
Комментарий
1960—1970-е годы ознаменовались интенсивным изучением мозгового кровообращения и ауторегуляции мозгового кровотока (АМК). Морфологические исследования позволили обнаружить нервные волокна в стенках мозговых сосудов от виллизиева круга и его ветвей до мельчайших артериол. Нервные клетки, волокна и рецепторы выявлены в соединительнотканных струнах, стабилизирующих артерии в ликворных каналах субарахноидального пространства. Богатой иннервацией обладают магистральные артерии, особенно развит нервный аппарат в области сифона внутренней сонной артерии. Наличие нервной регуляции мозгового кровообращения ни у кого не вызывает сомнений. Однако механизмы этой регуляции остаются невыясненными. Прежде всего непонятна природа центральных механизмов, участвующих в регуляции просвета мозговых сосудов. Одни предполагают, что функцию такого центра регуляции могут выполнять нейроны или их группы, которые находятся в самой коре, поблизости от артерий-эффекторов, другие ищут этот центр в ретикулярной формации, ядрах шатра и гипоталамусе.
Авторы провели исследование АМК у 37 пациентов с ДАП головного мозга, используя мониторинг коэффициента реактивности мозговых сосудов. Всех больных они разделили на две сравнимые по остальным показателям группы: с сохранной (19 больных) и с частично или полностью утраченной АМК (18). МРТ выявила в той и другой группах по 15 больных с повреждениями стволовых структур головного мозга. Статистический анализ с применением современного пакета программ обнаружил, что повреждение мозга в проекциях дофаминергической структуры черной субстанции и холинергической структуры в зоне безымянной субстанции ядра Мейнерта достоверно чаще встречались у пациентов с нарушенной АМК. Выявленная закономерность представляет не только теоретический интерес, но большое практическое значение.
Известно, что поражение черной субстанции и ядра Мейнерта патогномонично для болезни Паркинсона. Расстройствами АМК можно было бы объяснить усугубление состояния больных после хирургического лечения, осложнившегося пневмоцефалией. Исследования последних лет подтверждают изменение ауторегуляции при идиопатическом паркинсонизме. Однако это не обязательно расстройства АМК. Вероятно, центральные механизмы АМК устроены значительно сложнее, чем просто локализация их в указанных авторами структурах мозга.
Проблема, затронутая в данной статье, безусловно, требует дальнейшего более детального изучения. Результаты проведенной авторами работы заслуживают быть опубликованными.
А.Л. Кривошапкин (Москва)
Список литературы:
- Zweifel С, Dias С, Smielewski P, Czosnyka M. Continuous time-domain monitoring of cerebral autoregulation in neurocritical care. Medical Engineering and Physics. 2014 1 May;36: Issue 5:638-645. https://doi.org/10.1016/j.medengphy.2014.03.002
- Lassen NA. Cerebral blood flow and oxygen consumption in man. Physiol Rev. 1959;39:183-238.
- Johnson U, Nilsson P, Ronne-Engström E, Howells T, Enblad P. Favorable outcome in traumatic brain injury patients with impaired cerebral pressure autoregulation when treated at low cerebral perfusion pressure levels. Neurosurgery. 2011;68:714-722. https://doi.org/10.1227/neu.0b013e3182077313
- Attwell D, Buchan AM, Charpak S, Lauritzen M, Macvicar BA, Newman EA. Glial and neuronal control of brain blood flow. Nature. 2010;468:232-243. https://doi.org/10.1038/nature09613
- Betz E. Cerebral blood flow: Its measurement and regulation. Physiol Rev. 1972;52:595-630. https://doi.org/10.1152/physrev.1972.52.3.595
- Bor-Seng-Shu E, Kitaw S, Figueiredo EG, Paiva wS, Fonoff ET, Teixeira MJ, Panerai RB. Cerebral hemodynamics: concepts of clinical Importance. Arq Neuropsiquiatr. 2012;70(5):357-365. https://doi.org/10.1590/s0004-282x2012000500010
- Bratton SL, Chestnut RM, Ghajar J, McConnell Hammond FF, Harris OA, Hartl R, Manley GT, Nemecek A, Newell DW, Rosenthal G, Schouten J, Shutter L, Timmons SD, Ullman JS, Videtta W, Wilberger JE, Wright DW. Guidelines for the management of severe traumatic brain injury. VII. Intracranial pressure monitoring technology. J Neurotrauma. 2007;24(Suppl 1):S45-S54. https://doi.org/10.1089/neu.2007.9990
- Lundberg N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta Psychiatr Neural Scand. 1960;36(Suppl 149):1-193. https://doi.org/10.1097/00005072-196207000-00018
- Risberg J, Lundberg N, lngvar DH. Regional cerebral blood volume during acute transient rises of the intracranial pressure (plateau waves). J Neurosurg. 1969;31:303-310. https://doi.org/10.3171/jns.1969.31.3.0303
- Сzosnyka M, Smielewski P, Kirkpatrick P, Laing RJ, Menon D, Pickard JD. Continuous assessment of the cerebral vasomotor reactivity in head injury. Neurosurgery. 1997;41:11-17. https://doi.org/10.1097/00006123-199707000-00005
- Ошоров А.В., Савин И.А., Горячев А.С., Попугаев К.А., Потапов А.А., Гаврилов А.Г. Первый опыт применения мониторинга ауторегуляции мозговых сосудов в остром периоде тяжелой черепно-мозговой травмы. Анестезиология и реаниматология. 2008;2:61-67. https://doi.org/10.14412/1995-4484-2008-8
- Ошоров А.В., Савин И.А., Горячев А.С., Попугаев К.А., Полупан А.А., Сычев А.А., Гаврилов А.Г., Кравчук А.Д., Захарова Н.Е., Данилов Г.В., Потапов А.А. Плато волны внутричерепного давления у пострадавших с тяжелой черепно-мозговой травмой. Анестезиология и реаниматология. 2013;4:44-50. 13.Obrador S, Pi-Suiier j. Experimental swelling of the brain. Arch Neural Psychiatry. 1943;49:826-830. https://doi.org/10.1001/archneurpsyc.1943.02290180050005
- Ishii S. Brain swelling. Studies of structural, physiological and biochemical alterations. In: Caveness WH, Walker AF, eds. Head Injury Conference Proceedings. Philadelphia: Lippincott, 1966;276-299.
- Meyer JS, Teraura T, Sakamoto K, Kondo A. Central neurogenic control of cerebral blood flow. Neurology. 1971;21:247-262. https://doi.org/10.1212/wnl.21.3.247
- Ladecola C, Nakai M, Arbit E, Reis D. Global cerebral vasodilatation elicited by focal electrical stimulation within the dorsal medullary reticular formation in anesthetized rat. J Cereb Blood Flow Metab. 1983;3:270-279. https://doi.org/10.1038/jcbfm.1983.41
- Maeda M, Matsuura S, Tanaka K, Katsuyama J, Nakamura T, Sakamoto H, Nishimura S. Effects of electrical stimulation on intracranial pressure and systemic arterial blood pressure in cats. Part I: Stimulation of brain stem. Neurol Res. 1988a Jun;10(2):87-92. https://doi.org/10.1080/01616412.1988.11739821
- Александрова Е.В., Тоноян А.С., Сычев А.А., Крюкова К.К. Активность симпато-адреналовой системы в остром периоде тяжелой черепно-мозговой травмы: значение нейроанатомических факторов. Вестник РФФИ. 2016;2(90):41-49. https://doi.org/10.22204/2410-4639-2016-090-02-41-49
- Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet. 1974 Jul 13;2(7872):81-84. https://doi.org/10.1016/S0140-6736(74)91639-0
- Jennett B, Plum F. Persistent vegetative state after brain damage: A syndrome in search of a name. Lancet. 1972;1:734-737. https://doi.org/10.1016/S0140-6736(72)90242-5
- Firsching R, Woischneck D, Klein S, Reissberg S, Döhring W, Peters B. Classification of severe head injury based on magnetic resonance imaging. Acta Neurochir (Wien). 2001;143:263. https://doi.org/10.1007/s007010170106
- Захарова Н.Е., Потапов А.А., Корниенко В.Н., Пронин И.Н., Александрова Е.В., Данилов Г.В., Гаврилов А.Г., Зайцев О.С., Кравчук А.Д., Сычев А.А. Новая классификация травматических поражений головного мозга, основанная на данных магнитно-резонансной томографии. Вестник РФФИ. 2016;2(90):12-19. https://doi.org/10.22204/2410-4639-2016-090-02-12-19
- Потапов А.А., Крылов В.В., Гаврилов А.Г., Кравчук А.Д., Лихтерман Л.Б., Петриков С.С., Талыпов А.Э., Захарова Н.Е., Ошоров А.В., Сычев А.А., Александрова Е.В., Солодов А.А. Рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Часть 3. Хирургическое лечение (опции). Вопросы нейрохирургии им. Н.Н. Бурденко. 2016;2:93-101.https://doi.org/10.17116/neiro201680293-101
- Потапов А.А., Крылов В.В., Гаврилов А.Г., Кравчук А.Д., Лихтерман Л.Б., Петриков С.С., Талыпов А.Э., Захарова Н.Е., Ошоров А.В., Сычев А.А., Александрова Е.В., Солодов А.А. Рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Часть 2. Интенсивная терапия и нейромониторинг. Вопросы нейрохирургии им. Н.Н. Бурденко. 2016;80(1):98-106. https://doi.org/10.17116/neiro201680198-106
- Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons; Joint Section on Neurotrauma and Critical Care, AANS/CNS, Bratton SL, Chestnut RM, Ghajar J, McConnell Hammond FF, Harris OA, Hartl R, Manley GT, Nemecek A, Newell DW, Rosenthal G, Schouten J, Shutter L, Timmons SD, Ullman JS, Videtta W, Wilberger JE, Wright DW. Guidelines for the management of severe traumatic brain injury. VII. Intracranial pressure monitoring technology. J Neurotrauma. 2007;24 Suppl 1:S45-S54. https://doi.org/10.1089/neu.2007.9989
- Niimi T, Sawada T, Kuriyama Y, The effect of dopamine on cerebral circulation and metabolism in man. Jpn J Stroke. 1981;3:318-325.
- Ångyán L. Role of the substantia nigra in the behavioral-cardiovascular integration in the cat. Acta Physiol Scand. 1989;74:175-187.
- Lin MT, Yang JJ. Stimulation of the nigrostriatal dopamine system produces hypertension and tachycardia in rats. Am J Physiol. 1994 Jun;266(6 Pt 2):H2489-H2496. https://doi.org/10.1152/ajpheart.1994.266.6.H2489
- Dampney RAL. Functional organization of central pathways regulating the cardiovascular system. Physiol Rev. 1994;74:323-364. https://doi.org/10.1152/physrev.1994.74.2.323
- Sun MK. Central neural organization and control of sympa- thetic nervous system in mammals. Prog Neurobiol. 1995;47:157-233. https://doi.org/10.1016/0301-0082(95)00026-8
- Ciriello J, Janssen SA. Effect of glutamate stimulation of bed nucleus of the stria terminalis on arterial pressure and heart rate. Am J Physiol. 1993;265 (Heart Circ Physiol. 34): H1516-H1522. https://doi.org/10.1152/ajpheart.1993.265.5.H1516
- Roder S, Ciriello J. Contribution of bed nucleus of the stria terminalis to the cardiovascular responses elicited by stimulation of the amygdala. J Auton Nerv Syst. 1993;45:61-75. https://doi.org/10.1016/0165-1838(93)90362-X
- Alexander N, Hirata Y, Nagatsu T. Reduced tyrosine hydroxylase activity in nigrostriatal system of sinoaortic-denervated rats. Brain Res. 1984;299:380-382. https://doi.org/10.1016/0006-8993(84)90724-8
- Alexander N, Nakahara D, Ozaki N, Kaneda N, Sasaoka T, Iwata N, Nagatsu T. Striatal dopamine release and metabolism in sinoaortic-denervated rats by in vivo microdialysis. Am J Physiol. 1988;254. (Regulatory Integrative Comp Physiol. 1988;23):R396-R399. https://doi.org/10.1152/ajpregu.1988.254.2.R396
- Kirouac GJ, Ciriello J.Cardiovascular depressor responses to stimulation of substantia nigra and ventral tegmental area. Am J Physiol. 1997 Dec;273(6 Pt 2):H2549-H2557. https://doi.org/10.1152/ajpheart.1997.273.6.H2549
- Sato A, Sato Y, Uchida S. Regulation of regional cerebral blood flow by cholinergic fibers originating in the basal forebrain. Int J Dev Neurosci. 2001 Jun;19(3):327-337. Review. https://doi.org/10.1016/S0736-5748(01)00017-X
- Maeda M, Miyazaki M. Control of ICP and the cerebrovascular bed by the cholinergic basal forebrain. Acta Neurochir Suppl. 1998;71:293-296. https://doi.org/10.1007/978-3-7091-6475-4_85
- Gregor K. Wenning, Carlo Colosimo, Felix Geser and Werner Poewe. Multiple system atrophy. Lancet Neurology. 2004;3:93-103. https://doi.org/10.1016/S1474-4422(03)00662-8
- Ariza D, Sisdeli L, Crestani CC, Fazan R, Martins-Pinge MC. Dysautonomias in Parkinson’s disease: cardiovascular changes and autonomic modulation in conscious rats after infusion of bilateral 6-OHDA in substantia nigra. Am J Physiol Heart Circ Physiol. 2015 Feb 1;308(3):H250-H257. https://doi.org/10.1152/ajpheart.00406.2014