Кутин М.А., Сиднева Ю.Г., Коновалов А.Н., Пронин И.Н., Кадашев Б.А., Калинин П.Л., Шкарубо А.Н., Семенова Ж.Б., Фомичев Д.В., Шарипов О.И., Шульц Е.И., Лубнин А.Ю., Попугаев К.А., Савин И.А., Астафьева Л.И., Клочкова И.С., Шишкина Л.В., Добровольский Г.Ф., Ротин Д.В., Саватеев А.Н. и др.
АД - артериальное давление
ВВЭ - венозная воздушная эмболия
ВСА - внутренняя сонная артерия
ИВЛ - искусственная вентиляция легких
КМА - калия магния аспарагинат
КТ - компьютерная томография
КФК - креатининфосфокиназа
ЛДГ -лактатдегидрогеназа
ЛЖ - левый желудочек
ЛСК - линейная скорость кровотока
НСА - наружная сонная артерия
ОРДС - острый респираторный дистресс-синдром
ОСА - общая сонная артерия
ПА - позвоночная артерия
ПВЭ - парадоксальная воздушная эмболия
ПДКВ - положительное давление конца выдоха
СИ - сердечный индекс
УЗИ - ультразвуковое исследование
ФВ - фракция выброса
ЧД - частота дыхания
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиография
ЭхоКГ - эхокардиография
ЭЭГ - электроэнцефалография
EtCO2 - показатель углекислого газа в конце выдоха
FiO2 - фракция кислорода в дыхательной смеси
SpO2 - пульсоксиметрия
Парадоксальная воздушная эмболия - редкое, но потенциально тяжелое, жизнеугрожающее осложнение, при котором воздушные эмболы из правых отделов сердца и легочной артерии попадают в артерии большого круга кровообращения, вызывая их окклюзию. В нейрохирургической практике ПВЭ наиболее часто встречается при операциях в положении сидя либо в положении с возвышенным головным концом - как вторичное осложнение венозной воздушной эмболии [1-4]. Внутрисердечное шунтирование через не полностью заращенное овальное окно - наиболее частая причина ПВЭ, но к парадоксальной эмболии во время анестезии может привести и функционирование внутрилегочных артериовенозных шунтов [5, 6]. Потенциально эти воздушные эмболы могут попасть в любые артериальные сосуды, однако чаще всего отмечается их попадание в сосуды головного мозга (ветви средней мозговой артерии) [1, 2]. Однако в описываемом нами клиническом наблюдении ПВЭ привела к нарушению не только мозгового кровообращения, но и коронарного, с формированием острого инфаркта миокарда.
Клиническое наблюдение. Мужчина, 48 лет, поступил в НИИ нейрохирургии с диагнозом «астроцитома продолговатого мозга и холестеатома левого мостомозжечкового угла» для выполнения открытой биопсии опухоли продолговатого мозга в условиях нейрофизиологического мониторинга. На догоспитальном этапе выполнены: ЭКГ, ЭЭГ, УЗИ вен нижних конечностей, общий и биохимический анализ крови, общий анализ мочи - отклонений от возрастной нормы выявлено не было. По данным анамнеза, какая-либо патология сердца у пациента отсутствовала.
В операционной пациенту выполнен стандартный мониторинг, включавший в себя трехканальную ЭКГ, инвазивное измерение артериального давления, пульсоксиметрию (SpO2). После индукции анестезии (пропофол + фентанил + рокуроний) проведена оротрахеальная интубация трахеи без технических сложностей, начато измерение углекислого газа в конце выдоха (EtCO2). ИВЛ проводилась в режиме принудительной механической вентиляции (CMV), МОД=6,0 л/мин, ЧД=14, фракция вдыхаемого кислорода 35%. Без технических сложностей пунктирована и катетеризирована трехпросветным катетером правая яремная вена, положение катетера в венозном русле подтверждено получением обратного тока крови по трем портам. Голова пациента была фиксирована в скобе Мейфилда. Перед переводом в положение сидя АД составило 130-100/70-60 мм рт.ст., ЧСС 70 уд/мин, SpO2=99%, EtCO2=37 мм рт.ст. После перевода пациента в положение сидя отмечалась непродолжительная артериальная гипотензия (минимальное АД 50/40 мм рт. ст), гемодинамика стабилизирована форсированным в/в введением кристаллоидных и коллоидных растворов (NaCl 0,9% 800 мл, КМА 250 мл, тетраспан 500 мл). АД стабилизировано на уровне 90/40 мм рт.ст.
На этапе трепанации черепа зафиксирован кратковременный эпизод венозной воздушной эмболии из неустановленного источника со снижением EtCO2 с 36 до 20 мм рт.ст. и SpO2 - с 98 до 93%, сопровождавшийся снижением АД до 50/30 мм рт.ст., в связи с чем начата вазопрессорная поддержка норадреналином в дозе 0,03 мкг/кг в минуту. В результате АД стабилизировано на уровне 140-110/70-50 мм рт.ст. На этапе проведения биопсии новообразования ствола мозга произошел повторный эпизод массивной венозной воздушной эмболии со снижением SpO2 до 94%, EtCO2 до 23 мм рт.ст., АД до 20/10 мм рт.ст., потребовавший увеличения вводимой дозы норадреналина до 0,1 мкг/кг в минуту, проведения непрямого массажа сердца в течение 3 мин (аускультативно над правыми отделами сердца выслушивался характерный для воздушной эмболии «шум мельничных колес»), перевода пациента на дыхание 100% кислородом. Данный эпизод сопровождался появлением изменений на ЭКГ-мониторе, свидетельствующих о развитии миокардиальной ишемии. Источник эмболии остался неустановленным, несмотря на мануальную компрессию шейных вен. В связи с подозрением на кардиальную катастрофу интраоперационно была снята 12-канальная ЭКГ. На ЭКГ отмечалось появление признаков острого коронарного синдрома (элевация сегмента ST V1-V5, формирование зубца QS V1-V2) (рис. 1), которых не было на дооперационной электрокардиограмме (рис. 2).
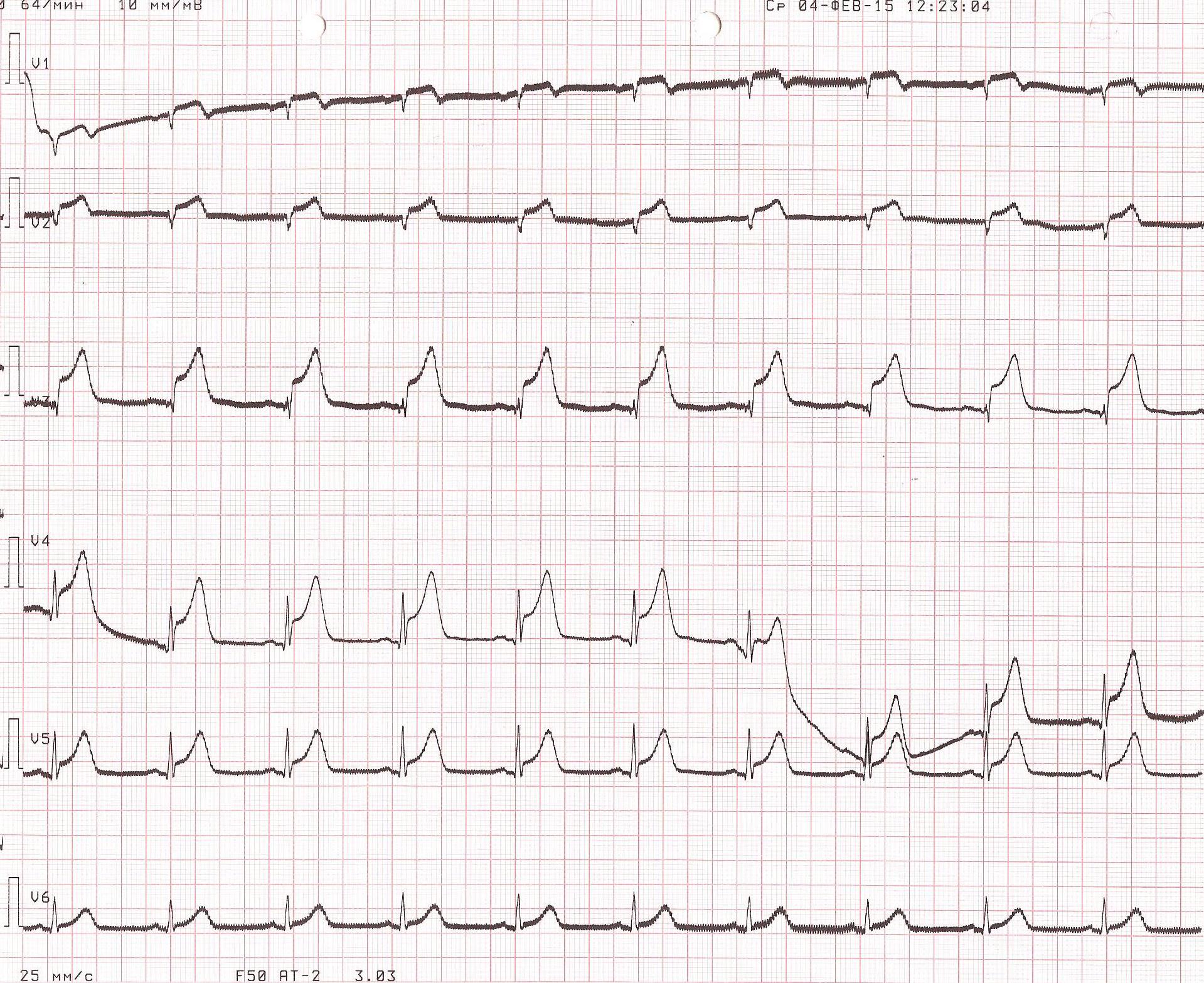
Рис. 1. ЭКГ пациента, выполненная интраоперационно. Ритм синусовый, горизонтальная ЭОС. Элевация сегмента ST V1-V5, формирование зубца QS V1-V2.

Рис. 2. ЭКГ пациента до операции. Какая-либо патология отсутствует. АД удалось стабилизировать на уровне 120/70 мм рт.ст., ЧСС - 80 уд/мин. Учитывая развитие тяжелого интраоперационного осложнения, операцию решено прекратить, и пациент в состоянии наркозного сна доставлен в отделение реанимации и интенсивной терапии, где была продолжена ИВЛ в режиме синхронизированной перемежающейся принудительной вентиляции (SIMV) - PC, ЧД=12, FiO2=0,4, SpO2=99%. Сохранялась тенденция к гипотонии, требовавшая дополнительной инфузионной терапии коллоидными и кристаллоидными растворами и увеличения дозы норадреналина. На рентгенограмме органов грудной полости (рис. 3) появилось диффузное снижение прозрачности обоих легочных полей по типу «матового стекла».
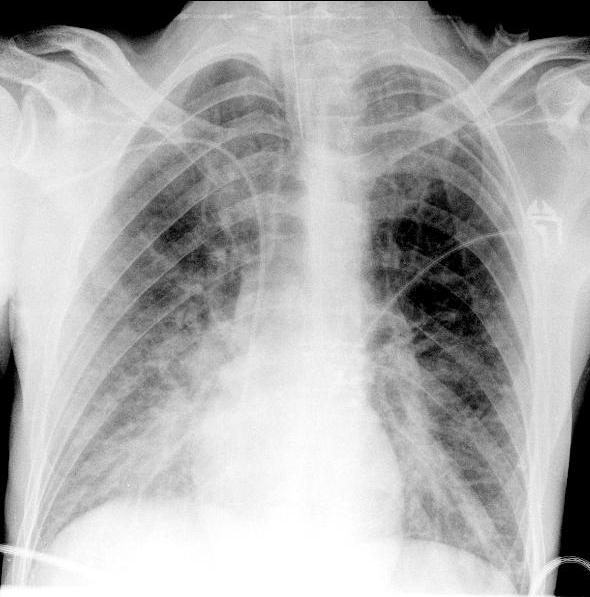
Рис. 3. Рентгенограмма органов грудной полости в прямой проекции. Тень средостения не смещена. Отмечается выраженное диффузное снижение прозрачности легочной ткани по типу «матового стекла». Выполнена ЭхоКГ, по данным которой отмечалась субтотальная гипокинезия левого желудочка со снижением показателей насосной функции сердца: ФВ 41-42%, СИ=1,8 л/мин·м2. По данным биохимического анализа крови, тропонин 1,06 мкг/л (N<0,1 мкг/л); КФК 166 Ед/л (N<200 Ед/л).
В связи с отсутствием признаков пробуждения в течение 2 ч и нарастанием неврологической симптоматики в виде появления анизокории (D>S) выполнена компьютерная томография головного мозга, выявившая массивную пневмоцефалию (рис. 4).
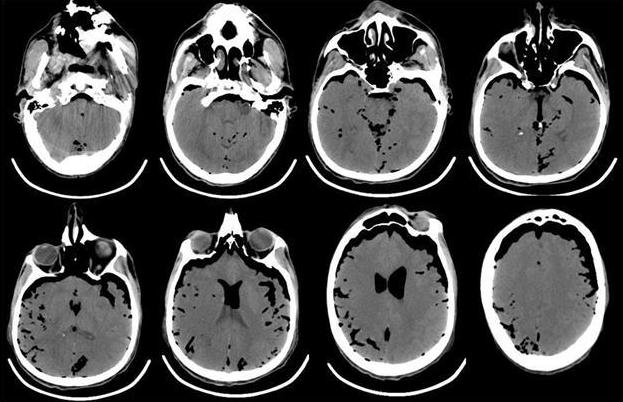
Рис. 4. КТ-головного мозга пациента, выполненная сразу после операции. Отмечается выраженная пневмоцефалия. В течение первых 12 ч после операции в структуре неврологического статуса у больного отмечалось нарастание общемозговой и очаговой неврологической симптоматики. Отсутствовала реакция на обращенную речь, болевое и струйное раздражение лица. При пассивном поднимании век взор неподвижный, двусторонний мидриаз без фотореакции. Роговичные, окулоцефалический и кашлевой рефлексы отсутствуют. Мышечная атония, арефлексия. Гемодинамика с тенденцией к артериальной гипотензии, несмотря на возрастающие дозы норадреналина максимально до 5 мкг/кг в минуту. Выполненная повторная КТ через 12 ч с момента поступления из операционной выявила диффузный отек головного мозга с отсутствием дифференцировки серого и белого вещества, пневмоцефалию (рис. 5).
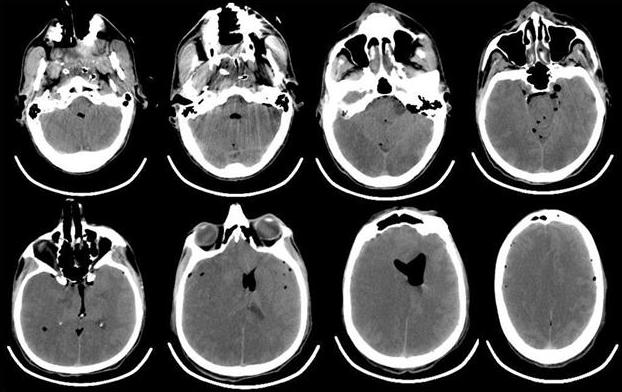
Рис. 5. КТ-головного мозга пациента, выполненная через 12 ч после операции. Отмечается формирование выраженного отека мозгового вещества, с признаками латеральной дислокации. Остаточная пневмоцефалия. Снижение дифференцировки серого и белого вещества. В первые послеоперационные сутки состояние пациента оставалось без положительной динамики, сохранялись диффузная мышечная атония, арефлексия, артериальная гипотония на фоне применения высоких доз норадреналина. По результатам биохимического анализа крови: КФК 845 (N<200 Ед/л), ЛДГ 665 Ед/л (N=100-190 Ед/л), тропонин 18,76 (N<0,1 мкг/л). По данным допплерографии, артерии виллизиева круга не визуализируются. В артериях шеи (ОСА, ВСА, НСА и ПА) при цветном допплеровском картировании прокрашивание спонтанное, ЛСК=20 см/с. Повторно выполнена ЭхоКГ, которая показала: ФВ 31-33%, СИ=2,6 л/мин·м2, увеличение размеров Л.Ж. Значительное снижение локальной сократимости ЛЖ с формированием аневризмы в области верхушки и средних отделов ЛЖ с формирующимися неплотно фиксированными тромботическими массами, практически занимающими всю верхушку, и значительное снижение показателей насосной функции ЛЖ.
В дальнейшем состояние пациента оставалось крайне тяжелым - атоническая кома; гемодинамические параметры поддерживались в пределах нормальных значений только на фоне постоянной инфузии норадреналина в максимальной дозировке. На 12-е сутки нахождения в отделении реанимации и интенсивной терапии констатирована смерть пациента: он скончался на фоне нарастающей сердечно-сосудистой недостаточности. Вскрытие пациента не производилось по настоянию его родственников.
В приведенном клиническом случае описано достаточно редкое наблюдение развития парадоксальной воздушной эмболии с поражением сосудов головного мозга, коронарных артерий и легких. В литературе нами найдено лишь несколько описаний похожих клинических наблюдений. При этом стоит отметить, что воздушная эмболия коронарных сосудов, описанная во всех литературных источниках, проявлявшаяся изменениями на электрокардиограммах и гемодинамической нестабильностью, регрессировала в течение небольшого промежутка времени (до 30 мин), на фоне инотропной и инфузионной терапии. Также во всех наблюдениях отмечалось преимущественное попадание воздушных эмболов в правую коронарную артерию [7, 8].
Венозная воздушная эмболия является достаточно распространенным осложнением нейрохирургических вмешательств, выполняемых в положении сидя [2, 4, 9-12]. По данным разных авторов [1-3, 5, 11, 13], частота данного осложнения колеблется в диапазоне 1,6-76%, в зависимости от того, какие эпизоды ВВЭ фиксируют авторы (все или только массивные), и использованного метода диагностики ВВЭ, которые обладают различной чувствительностью. Наиболее часто органом-мишенью при воздушной эмболии являются легкие. Тяжесть легочного повреждения варьирует от бессимптомного до ОРДС [1, 2]. При наличии открытого овального окна или внутрилегочного шунта создаются предпосылки для попадания воздуха в большой круг кровообращения [1, 2, 6, 14]. При этом могут возникать ишемические повреждения любых органов, однако наиболее часто поражаются головной мозг, кожные покровы, миокард [1, 2, 5]. Частота встречаемости открытого овального окна в популяции, по данным разных авторов (прежде всего по результатам секционного исследования случайных неотобранных умерших от разных причин), составляет от 5 до 33% [3, 5, 13, 15]. Предоперационное обследование, включающее трансторакальную допплерографию с проведением теста Вальсальвы и применением контраста, не позволяет у 1/3-½ части пациентов выявить данную аномалию [16]. Во-первых, метод трансторакальной допплерографии недостаточно чувствителен для выявления открытого овального окна; во-вторых, в ряде случаев овальное окно начинает функционировать лишь в условиях повышенного внутригрудного давления при проведении ИВЛ. Особенно ситуация усугубляется при развитии ВВЭ, так как возникающее повышенное давление в правом желудочке вследствие массивного попадания воздуха в легочные капилляры приводит к повышению давления в малом круге кровообращения и открытию овального окна. Это клинически достаточно важная информация в аспекте профилактики ПВЭ: 1) с помощью даже трансэзофагеальной ЭхоКГ мы можем, и то не всегда, диагностировать у больного наличие функционирующего овального отверстия; 2) наличие же и функционирование сосудистых анастомозов между системой легочной артерии и бронхиальными артериями диагностировать вообще невозможно, они ответственны за летальные исходы вследствие ПВЭ с верифицированным отсутствием септальных дефектов в сердце [17].
Специфических методов лечения повреждения легких на фоне венозной воздушной эмболии в настоящее время нет. Существует ряд работ, показывающих эффективность гипербарической оксигенотерапии у пациентов, перенесших ВВЭ. Стоит отметить, что данная терапия применялась у ныряльщиков с аквалангом, которые вследствие нарушения техники всплытия переносили кессонную болезнь, когда также отмечается появление пузырьков азота в кровеносном русле [18, 19]. Есть данные об эффективности ИВЛ 100% для вымывания азота и таким образом уменьшения объема пузырьков воздуха [20]. В целом лечение ВВЭ носит симптоматический характер и направлено на коррекцию органной недостаточности. При ВВЭ повреждение легких зачастую носит характер классического ОРДС [19, 21]. В этих случаях, согласно концепции открытых легких, проводится респираторная поддержка, включающая проведение рекрутмент-маневра и использование адекватного уровня ПДКВ. При наличии открытого овального окна или внутрилегочного шунтирования, приведшего к ПВЭ, может развиться полиорганная недостаточность, требующая соответствующего подхода и интенсивной терапии [22]. Повреждение головного мозга при ПВЭ обусловливает необходимость проведения нейропротекции. Одним из наиболее эффективных методов нейропротекции является проведение ретроградной церебральной перфузии и церебральной или системной гипотермии, однако эффективность данной методики у пациентов с парадоксальной воздушной эмболией в настоящий момент мало изучена [12, 23, 24]. Воздушная эмболия коронарных сосудов может приводить к развитию инфаркта миокарда, клинические и лабораторные проявления которого неотличимы от инфаркта миокарда атеротромботического генеза. Однако, учитывая отсутствие коронарного тромбоза, подходы к лечению острого инфаркта миокарда вследствие ПВЭ отличаются от принятых стандартов ведения пациентов с острым коронарным синдромом. Очевидно, что проведение фибринолитической, антиагрегантной и антикоагулянтной терапии у данной категории пациентов будет неэффективно и даже опасно из-за риска интракраниальных геморрагических осложнений при введении антикоагулянтов и фибринолитиков на фоне свежей нейрохирургической раны. Основными терапевтическими опциями являются коррекция центральной гемодинамики, при необходимости использование инотропной поддержки [25]. Также представляется целесообразным назначение β-адреноблокаторов, обеспечивающих, во-первых, удлинение диастолы и таким образом улучшение коронарной перфузии, а во-вторых, уменьшение потребности миокарда в кислороде и уменьшение зоны некроза.
Отсутствие специфических методов лечения венозной воздушной эмболии и ПВЭ и тяжесть их течения подчеркивают важность профилактики. По данным ряда авторов [2, 14, 16, 26, 27], использование транспищеводной ЭхоКГ во время проведения оперативного вмешательства позволяет быстро обнаружить и исключить возможность появления венозной воздушной эмболии у пациентов из группы риска. Установка транспищеводного датчика и фиксация его таким образом, чтобы после перевода пациента в положение сидя на экране монитора были видны верхняя полая вена, правое предсердие и ЛЖ, позволяет вовремя выявить появление микропузырьков воздуха в кровеносном русле. Также этот метод позволяет интраоперационно определить наличие и функционирование открытого овального окна, что теоретически даст возможность снизить риск возникновения венозной и парадоксальной воздушной эмболии [2, 16]. Однако проблематичность этого рассуждения рассмотрена выше.
Разработанный Бунегиным и Элбиным метод эвакуации воздушного эмбола из правых отделов сердца через специальный многопросветный катетер является весьма эффективным в лечении ВВЭ, но корректная установка аспирационного катетера - далеко не простая процедура, которая должна проводиться в условиях рентгенологического контроля [28].
Естественно, что методы профилактики ВВЭ у нейрохирургических больных, оперируемых в положении сидя, позволяют снизить частоту и ПВЭ. Так, считается, что снижает риск возникновения ВВЭ проведение оперативного вмешательства в положении полусидя с приподнятым ножным концом операционного стола по методу S. Jadik и соавт. [29]. В этой позиции тазобедренные суставы согнуты максимально до 90°, ноги подняты кверху таким образом, что стопы пациента находятся выше его головы. Туловище максимально отклонено кзади, голова отклонена и фиксирована кпереди. При таком положении головы необходимо контролировать наличие достаточного пространства для осуществления компрессии яремных вен. Данное положение за счет повышения давления в правом предсердии также позволяет снизить риск ВВЭ. Это не единственная публикация, где за счет подъема нижних конечностей, форсированной инфузионной терапии коллоидными растворами и других хитростей авторы пытаются избежать отрицательного внутрисинусного давления [30]. В одной из таких работ вообще предлагалось надевать на больных специальные пневмокомпрессионные штаны («military anti shock trousers»), которые при инфляции выдавливают депонированную кровь из сосудов нижних конечностей [31]. Беда всех этих профилактических подходов в том, что все они весьма ограниченно эффективны и их профилактический эффект в серьезных исследованиях не подтвержден [1, 2].
Строго говоря, существуют три причины развития ВВЭ у нейрохирургических больных, оперируемых в положении сидя: 1) повреждение стенок синусов и крупных вен мозга при трепанации и доступе (практически неизбежная ситуация); 2) отсутствие защитного механизма спадения стенок поврежденных синусов и вен из-за ригидности их стенок (механизм, работающий в периферических венах); 3) отрицательное давление в венах и синусах мозга из-за постуральных эффектов кровообращения [1, 2]. Последний пункт является единственным, на который можно реально повлиять, и для этого предложено несколько методов [32].
Положительное давление в конце выдоха. Увы, метод оказался не только неэффективным, но и опасным. При высоких значениях ПДКВ эффект на величину внутрисинусного давления оказался обратным - оно снижалось, по-видимому, из-за снижения объемного мозгового кровотока [32]. В одном из исследований с помощью контрастной ЭхоКГ показано, что ПДКВ способствует переходу воздушных эмболов справа налево, т. е. повышает риск ПВЭ [33].
Надувной шейный турникет. Это простое устройство позволяет за счет наружной компрессии яремных вен на шее повысить давление в синусах мозга выше атмосферного [34]. Метод 100% эффективен, но трудоемок, так как для безопасности требует катетеризации одной из яремных вен (контроль величины венозного давления) выше уровня стояния турникета [32].
Управляемая умеренная гиперкапния. Метод был впервые описан группой немецких авторов еще в 1991 г. [35] и тоже оказался высокоэффективным, но при этом простым в реализации [32].
Однако самым эффективным методом профилактики ВВЭ у нейрохирургических больных является отказ от операций в положении сидя и переход на хирургию в положении лежа [36].
Таким образом, венозная воздушная эмболия у пациентов с открытым овальным окном или внутрилегочным шунтированием является редким, но реально жизнеугрожающим осложнением при выполнении нейрохирургических вмешательств в положении сидя. Эффективные меры, направленные на профилактику венозной воздушной эмболии, способны снизить риск и парадоксальной эмболии, и самой эффективной из этих мер является отказ от операций в положении сидя с переходом на хирургию в положении лежа.
Конфликт интересов отсутствует.
Коллектив авторов приводит клиническое наблюдение развития венозной и парадоксальной воздушной эмболии у пациента с опухолью ствола головного мозга. Это очень грозное, а порой фатальное осложнение нейрохирургических операций, выполняемых у пациентов в положении сидя. В статье обсуждаются различные подходы и методы, опубликованные ранее отечественными и зарубежными исследователями, направленные как на предупреждение развития воздушно-эмболических осложнений, так и на их лечение. Обсуждаются алгоритмы пред- и интраоперационного обследования и ведения пациентов. В ходе обсуждения данного клинического наблюдения авторы приводят данные литературы о возможных причинах венозных и парадоксальных воздушных эмболий в нейрохирургической практике.
В представленном клиническом наблюдении парадоксальная воздушная эмболия, развившаяся во время проведения нейрохирургического вмешательства в положении сидя, привела к формированию острого инфаркта миокарда и нарушению мозгового кровообращения, которые в конечном итоге явились причиной гибели пациента. Авторы акцентируют внимание читателей на способах пред- и интраоперационной диагностики данных осложнений, указывая, что эффективных способов лечения венозной и парадоксальной воздушной эмболий в настоящее время не разработано. Авторы приходят к выводу, один из которых указывает на необходимость перехода к выполнению нейрохирургических вмешательств в положении лежа во всех технически возможных случаях и максимальный отказ от хирургии в положении сидя - для снижения риска развития воздушно-эмболических осложнений.
Статья может быть полезна не только нейрохирургам и анестезиологам-реаниматологам, но и всем смежным специалистам, принимающим участие в лечение пациентов с поражением головного мозга.
С.В. Свиридов (Москва)
Список литературы:
О журнале Редколлегия Редакционная этика Авторам Порядок рецензирования Контакты Фотографии статьи Voprosy neirokhirurgii 2016 02 10 ris1 Рис. 1. ЭКГ пациента, выполненная интраоперационно. Ритм синусовый, горизонтальная ЭОС. Элевация сегмента ST V1-V5, формирование зубца QS V1-V2. Voprosy neirokhirurgii 2016 02 10 ris2 Рис. 2. ЭКГ пациента до операции. Какая-либо патология отсутствует. Voprosy neirokhirurgii 2016 02 10 ris3 Рис. 3. Рентгенограмма органов грудной полости в прямой проекции. Тень средостения не смещена. Отмечается выраженное диффузное снижение прозрачности легочной ткани по типу «матового стекла». Voprosy neirokhirurgii 2016 02 10 ris4 Рис. 4. КТ-головного мозга пациента, выполненная сразу после операции. Отмечается выраженная пневмоцефалия. Voprosy neirokhirurgii 2016 02 10 ris5 Рис. 5. КТ-головного мозга пациента, выполненная через 12 ч после операции. Отмечается формирование выраженного отека мозгового вещества, с признаками латеральной дислокации. Остаточная пневмоцефалия. Снижение дифференцировки серого и белого вещества.
Л. И. Астафьева, М. А. Кутин, Н. А. Мазеркина, В. П. Непомнящий, К. А. Попугаев, Б. А. Кадашев, Ю. Г. Сиднева, Ю. В. Струнина, И. С. Клочкова, Д. А. Церковная, П. Л. Калинин, И. А. Арефьева, Н. Н. Моченова
Внутричерепная гипертензия остается одной из ведущих причин высокой летальности и инвалидизации среди пострадавших с тяжелой черепно-мозговой травмой (ЧМТ) [1—4, 6]. Частота ее среди пострадавших с ЧМТ, находящихся в коме, колеблется от 40 до 60% [6—8]. Нейрохирургические методы занимают особое положение в арсенале методик коррекции внутричерепной гипертензии. К ним относятся: эвакуация интракраниальных гематом, наружное вентрикулярное дренирование, декомпрессивная краниоэктомия [1—3, 6]. Своевременная диагностика и быстрая эвакуация патологических интракраниальных масс является основным элементом при лечении пострадавших с ЧМТ, наряду с устранением факторов вторичного повреждения головного мозга. При травме головного мозга ключевыми способами диагностики нейрохирургических проблем являются методы нейровизуализации головного мозга: КТ, МРТ [3—5]. Показания для нейрохирургического вмешательства определяются на основании оценки волюмометрических критериев и их динамики: объема патологического субстрата, и степени компрессии базальных цистерн, величины смещения срединных структур мозга и т. д. [1, 4, 5]. Основным механизмом действия декомпрессии является создание дополнительного пространства для компенсации увеличенного внутричерепного объема [6—8, 11]. Считается, что эффективность декомпрессии зависит от размера декомпрессионного окна [9—11]. Дополнительным критерием в принятии решения о декомпрессивной краниоэктомии служит мониторинг ВЧД. При повышении внутричерепного давления (ВЧД) выше 20 мм рт.ст., которое не удается устранить методами интенсивной терапии (седация, обезболивание, гипервентиляция, гиперосмолярные растворы), принимается решение об усилении консервативной терапии и/или о декомпрессивной краниоэктомии. Параметры ВЧД, такие как средняя величина и длительность повышения выше 20 мм рт.ст., были использованы в двух последних рандомизированных исследованиях с применением декомпрессивной краниоэктомии [12, 13]. В этих исследованиях использовались разные дизайны, критерии включения, а также границы и длительность внутричерепной гипертензии для принятия решения о декомпрессии. По срокам выполнения декомпрессии в данных исследованиях условно разделяли на ранние вторичные, или нейропротективные, и отсроченные вторичные, когда нейрохирургическое вмешательство рассматривали как последнюю ступень коррекции внутричерепной гипертензии (ВЧГ) [14].
В нашем клиническом примере мы использовали патофизиологический подход к решению вопроса о декомпрессии на основании расширенного мониторинга ВЧД и церебрального перфузионного давления (ЦПД) и коэффициента ауторегуляции Prx [15]. Обсуждаемый пациент входил в группу пострадавших с ЧМТ, у которых выполнялась декомпрессия на фоне декомпенсации ауторегуляции мозговых сосудов и развития внутричерепной гипертензии [15]. Состояние декомпенсации и истощения резервов консервативной терапии мы оценивали на основании динамики коэффициента Prx выше 0,2. Оценка ауторегуляции мозговых сосудов проводилась с помощью корреляционного коэффициента Prx. Расчет Prx производился с помощью программы ICM Plus (Кембридж, Великобритания) и представлял коэффициент корреляции между ВЧД и САД. Коэффициент Prx рассчитывался автоматически по 40 последовательным усредненным значениям ВЧД и АД, данный расчет повторялся в пределах скользящего окна каждые 5 с. Значения Prx — от 1 до 0,2 расценивались как сохранная или частично сохранная ауторегуляция. Значения Prx от 0,2 до 1 расценивалось как полностью утраченная ауторегуляция.
Первые сутки с момента травмы. Пострадавший мужчина 39 лет получил травму при падении с квадроцикла. Утрата сознания на месте травмы. С места травмы был доставлен в городской стационар. На момент госпитализации состояние оценивалось как сопор, 9 баллов по шкале комы Глазго (ШКГ), отмечались периоды психомоторного возбуждения. Зрачки узкие, по средней линии, фотореакция слабая с двух сторон. Левосторонний гемипарез. На К.Т.: очаги ушибов в лобных долях с двух сторон, левой височной доле, конвекситальное субарахноидальное кровоизлияние (САК). Умеренный отек за счет левого полушария, охватывающая цистерна прослеживается. Желудочковая система и субарахноидальные пространства сужены. В связи с нарастанием дыхательной недостаточности, необходимостью проведения седативной терапии была выполнена интубация трахеи, проводилась искусственная вентиляция легких (ИВЛ). АД 130/80 мм рт.ст., ЧСС 108 уд/мин. Больной находился на ИВЛ, получал седативную, противоотечную, антибактериальную терапию.
Вторые сутки. Пострадавший был переведен в НИИ нейрохирургии. Диагноз: тяжелая открытая ЧМТ. Ушиб головного мозга тяжелой степени с формированием множественных очагов ушиба (33 вида) в лобных долях с двух сторон, левой височной доле. Линейный перелом затылочной кости слева с переходом на основание. Травматическое САК. На К.Т. сохраняется прежняя картина (рис. 1).
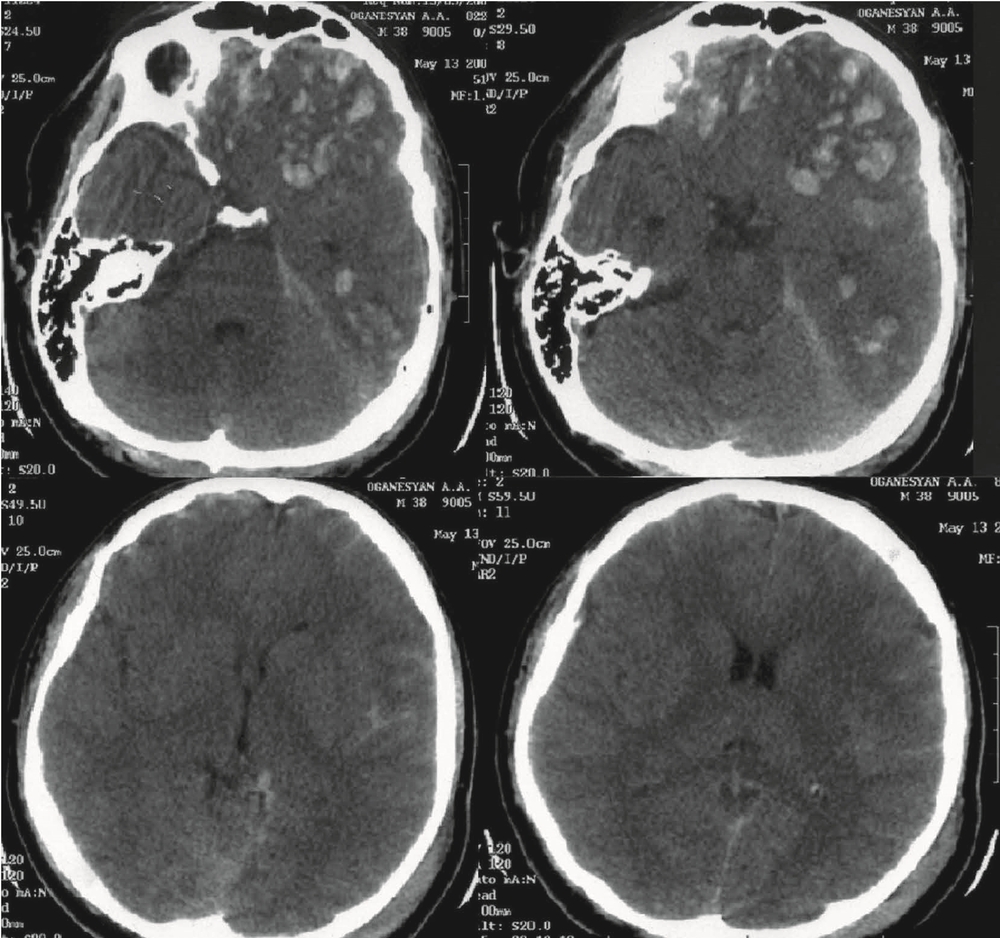
Неврологически: ШКГ 9 баллов, на настойчивое обращение получено сжимание в кистях рук. Фотореакция живая, корнеальный рефлекс получен, рефлекторный взор вверх получен на струйное раздражение. Нижнюю челюсть удерживает, живой кашлевой рефлекс. Сохраняется выраженное моторное беспокойство, стереотипность в движениях. АД в пределах 120—130/60—70 мм рт.ст. ЧСС 80—90 уд/мин. ИВЛ в режиме SIMV, RR 10, Vt 0,8 L, PS 14 cm H2O, PEEP 6 cm H2O, FiO2 40%. Учитывая данные КТ, острый период тяжелой ЧМТ, необходимость проведения седативной терапии, было принято решение о проведении мониторинга ВЧД. Паренхиматозный датчик показал: ВЧД 25—29 мм рт.ст., амплитуда ВЧД выше 7 мм рт.ст. Больному проводилась ИВЛ в режиме нормовентиляции, коррекция внутричерепной гипертензии и обеспечение ЦПД выше 60 мм рт.ст. Получал фентанил 100 мкг/ч и пропофол 150 мг/ч. При повышении ВЧД свыше 20 мм рт.ст. введение маннитола 1г/кг массы тела, вазопрессорная поддержка с целью контроля ЦПД.
Третьи сутки. При осмотре через 30 мин после отключения седации и наркотических анальгетиков, была отмечена отрицательная динамика — грубый орально-стволовой синдром в виде симптома Мажанди, узких зрачков, ограничение рефлекторного взора вверх, гиперсаливация. Глотательные движения и кашлевой рефлекс резко угнетены. Низкий мышечный тонус в конечностях. Неврологический осмотр был прекращен из-за эпизода повышения ВЧД до 30—35 мм рт.ст., которое устранено гипервентиляцией, возобновлением седации и аналгезии в прежних дозах, дополнительно проведена инфузия маннитола: 15%, 400 мл. От проведения теста с пробуждением в дальнейшем решено было отказаться. Осмолярность и уровень натрия в плазме были в норме. ИВЛ, SIMV, RR 14, Vt 0,78 L, PS 14 cm H2O, PEEP 6 cm H2O, FiO2 40%. ЕтСО2 30 мм рт.ст. В течение суток субфебрильная температура до 37,7—38 °C. Проводилась контролируемая нормотермия системой наружного охлаждения TropyCool до 36,5—37 °C. Гемодинамика поддерживалась вазопрессорами (мезатон 8—10 мг/ч). АД 135—165/70—90 мм рт.ст. По данным нейромониторинга (рис. 2), ВЧД от 18 до 35 мм рт.ст. ЦПД от 60 до 95 мм рт.ст., коэффициент ауторегуляции Prx — от 0,5 до 0,1.
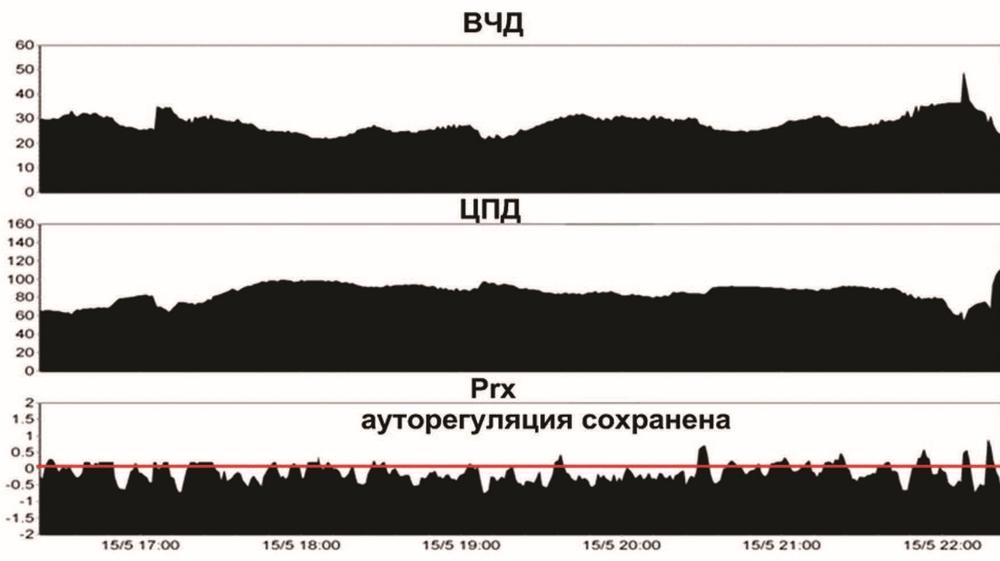
КТ повторно не выполнялась из-за нестабильной гемодинамики и ВЧГ, которую провоцировали минимальные манипуляции и изменение положения больного. Наложение трахеостомы было отложено до стабилизации состояния больного. Проводилась консервативная терапия под контролем нейромониторинга.
Четвертые сутки. Повторялись эпизоды ВЧГ. В течение их отмечено появление плато волн ВЧД до 40 мм рт.ст., кратковременное снижение ЦПД ниже 50 мм рт.ст. на фоне плато волн. В динамике отмечена устойчивая тенденция к увеличению коэффициента Prx выше 0,2, что свидетельствовало о срыве ауторегуляции мозгового кровотока (рис. 3).
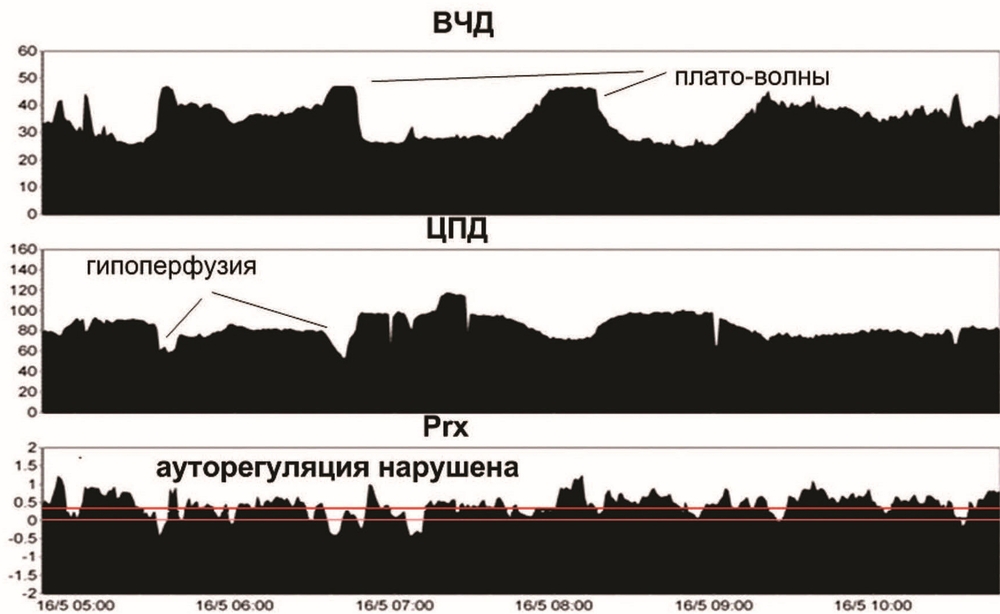
Произведено углубление седации: пропофол 250—300 мг/ч, фентанил в прежней дозе, глубокая гипервентиляция до ЕтСО2 28 мм рт.ст. под контролем югулярной оксиметрии SvjO2 не ниже 50%. Натрий — от 145 до 149 ммоль/л. Осмолярность — 310 мосмоль/л. В течение суток 15% раствор маннитола был использован четырехкратно, в общем объеме 1600 мл. После совместного обсуждения с нейрохирургами было решено выполнить декомпрессивную трепанацию. Операция: декомпрессивная краниоэктомия лобно-теменно-височной области с двух сторон. Удаление субдуральной гигромы слева объемом 30 мл. Пластика твердой мозговой оболочки надкостничным лоскутом слева.
5—6-е сутки. В послеоперационном периоде отмечалась стабилизация ВЧД 5–12 мм рт.ст., ЦПД на уровне 60—65 мм рт.ст., Prx>0,2 (рис. 4).
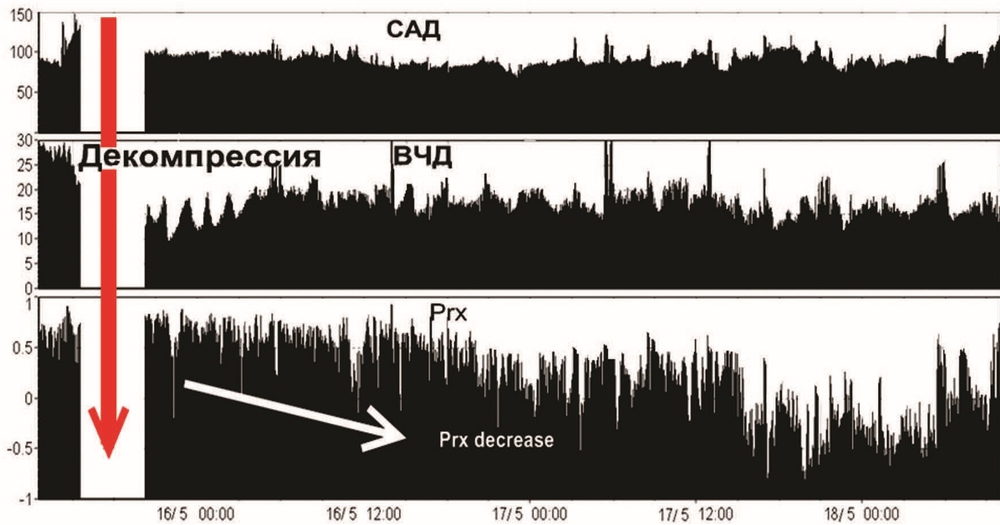
Доза пропофола снижена до 80 мг/ч, введение фентанила прекращено, доза мезатона уменьшена до 5 мг/ч. Контролируемая нормотермия прекращена, температура субфебрильная до 37,8 °C. При осмотре вне седации: ШКГ 6 баллов, приведение со сгибанием в правой руке, без отчетливой локализации, слабое сгибание в правой ноге. При пассивном открывании век глазные яблоки фиксированы в центральном положении, зрачки узкие, фотореакция ослаблена, слабый корнеальный рефлекс с двух сторон, редкие мигательные движения век. Нижняя челюсть отвисает, из ротовой полости обильное слюнотечение, язык несколько выступает за линию резцов, отечный. Нижнечелюстной рефлекс получен. АД 120—145/85—80 мм рт.ст., ЧСС 65–90 уд/мин, ритм синусовый. ИВЛ, SIMV RR 14, Vt 0,75 L, PS 12 cm H2O, PEEP 7 cm H2O, FiO2 40%. Дыхание в легких симметричное с двух сторон, жесткое, незначительное ослабление в заднебазальных отделах с двух сторон. Отмечается нарастание воспалительных маркеров в крови: лейкоцитоз со сдвигом формулы влево, ЦРП 178 мг/л. Рентгенологически — двусторонняя пневмония. Проводилась антибактериальная терапия с учетом чувствительности флоры. Выполнена транскутанная дилатационная трахеостомия.
7—11-е сутки. Стабилизация гемодинамики, прекращение вазопрессорной поддержки и седативной терапии. Сохранялась субфебрильная температура. АД 120—130/60—70 мм рт.ст. ЧСС 80—90 уд/мин. ВЧД в пределах 5—7 мм рт.ст., ЦПД 60—65 мм рт.ст. Значения Prx варьировали от 0 до –0,1, что свидетельствовало о восстановлении ауторегуляции. Нейромониторинг прекращен на 11-е сутки.
12—20-е сутки. Состоялся регресс инфекционно-воспалительных проявлений, нормализовалась температура, разрешилась двусторонняя пневмония. В неврологическом статусе положительная динамика: ШКГ 10 баллов, легкий правосторонний гемипарез. Выполняет отдельные инструкции: пожимает руки по просьбе, активно жестикулирует. Стабильная гемодинамика, проводилась дыхательная реабилитация, переведен в СРАР 5 cm H2O, FiO2 =25%, PS 10 cm H2O.
30-е сутки. Пациент на фоне восстановления сознания был отключен от ИВЛ. Гемодинамика стабильная. Через 22 мес в связи с появлением раневой ликвореи больному успешно выполнена плаcтика ТМО в левой лобно-теменно-височной области. Позже в связи с развитием гидроцефалии было выполнено вентрикуло-перитонеальное шунтирование справа. Через 5 мес пациент был выписан из стационара. В неврологическом статусе сохранялся легкий правосторонний гемипарез, сенсорно-моторная афазия. Восстановилось глотание, был деканюлирован. В дальнейшем пациент проходил курсы реабилитационно-восстановительного лечения до 2 раз в год. Через 12 мес состояние по шкале исходов Глазго оценивалось как умеренная инвалидизация.
Представленным клиническим примером показано, что наряду с традиционным мониторингом параметров ВЧД и ЦПД мониторинг ауторегуляции мозговых сосудов позволяет своевременно принимать решение о выполнении декомпрессивной краниоэктомии. В представленном клиническом наблюдении стойкая регистрация срыва ауторегуляции на 4-е сутки свидетельствовала о дальнейшей невозможности использования медикаментозных манипуляций со средним артериальным давлением и соответственно лишало возможности безопасного обеспечения ЦПД выше 60 мм рт.ст. В соответствии с вышесказанным любые попытки повышения САД приводили бы к пассивному повышению ВЧД и дальнейшему снижению ЦПД. Можно предположить, что при отсутствии мониторинга ауторегуляции интенсивная терапия протекала бы по варианту дальнейшего наращивания агрессивности, так как были сохранны резервы по использованию гиперосмолярных растворов, кроме того, удавалось снижать ВЧД на углубление седации и проводить безопасное углубление гипервентиляции под контролем югулярной оксиметрии. Однако в создавшейся клинической ситуации осмотические диуретики не могли рассматриваться как средство продленной коррекции ВЧГ, так как прослеживалась тенденция к гипернатриемии, а введение маннитола достигло максимальных суточных доз. При наращивании агрессивности лечения ВЧГ в арсенале реаниматолога оставались методы гипотермии и барбитуровой комы. Барбитураты способны эффективно устранять внутричерепную гипертензию, но количество побочных осложнений, вызванных их использованием, нивелирует их положительный эффект на ВЧД [16, 17]. Одним из грозных осложнений является артериальная гипотензия, которая является мощным повреждающим фактором для травмированного мозга и значительно ухудшает исход при ЧМТ [16, 17]. Можно предполагать, что использование барбитуратов у данного пациента потребовало бы более высоких доз вазопрессоров и агрессивной инфузионной терапии, что само по себе могло привести к различным осложнениям: отеку легких, почечной недостаточности, сердечно-сосудистой недостаточности и т. д. [18, 19]. Барбитураты на сегодняшний день рассматриваются как последняя ступень агрессивной терапии ВЧГ, и их использование не улучшает исходы при ЧМТ [1, 4, 6, 7, 16, 17].
Метод гипотермии зарекомендовал себя эффективным методом коррекции внутричерепной гипертензии. Однако международные многоцентровые исследования не показали улучшения исходов при использовании гипотермии в сравнении с традиционными методами интенсивной терапии [18]. При этом было отмечено, что количество побочных осложнений, связанных с использованием гипотермии, не уступает их количеству при использовании барбитуратов [19, 20]. Декомпрессивная краниоэктомия также не является панацеей, но в нашем клиническом случае продемонстрировала свою эффективность для коррекции ВЧГ и стабилизации ЦПД. Кроме того, после декомпрессии появилась возможность для снижения агрессивности методов интенсивной терапии в виде уменьшения доз седативных препаратов и катехоламинов. Мы смогли отменить наркотические анальгетики, отказаться от гипервентиляции, прекратить введение гиперосмолярных растворов и достигнуть нормализации уровня натрия и восстановления ауторегуляции.
Таким образом, продемонстрирована возможность нового подхода к принятию решения о декомпрессивной краниоэктомии у пострадавших с травматическим отеком головного мозга и внутричерепной гипертензией. Суть нового подхода заключается в непрерывной оценке ауторегуляции мозговых сосудов с помощью коэффициента Prx наряду с такими важными параметрами нейромониторинга, как ВЧД и ЦПД. Мониторинг коэффициента Prx позволяет своевременно распознавать срыв ауторегуляции мозговых сосудов и дает возможность принять решение о выполнении декомпрессивной краниоэктомии до момента наращивания агрессивных методов интенсивной терапии (гипотермии и барбитуровой комы).
Конфликт интересов отсутствует.
В клиническом примере, описанном группой авторов, представлены новые возможности нейромониторинга у пострадавших с тяжелой ЧМТ. Благодаря программному обеспечению, дополнительно с АД, ВЧД, ЦПД, проводилось непрерывное измерение статуса ауторегуляции мозгового кровотока с помощью коэффициента Prx (pressure reactivity index) [1].
Публикации последних 5–7 лет подтверждают, что данный параметр нейромониторинга занимает одно из ведущих мест и активно используется при определении стратегии интенсивной терапии у пострадавших с острым церебральным повреждением. Интерес к проблеме мониторинга ауторегуляции мозгового кровотока значительно возрос, и этому есть несколько причин. Во-первых, значимую роль играют доступность и низкая цена метода, основанного на компьютерном анализе медленноволновых колебаний АД и ВЧД. Именно этот факт обеспечил широкое распространение метода оценки ауторегуляции в нейроинтенсивной терапии. Во-вторых, актуальность мониторинга ауторегуляции была подчеркнута в Международных рекомендациях по ведению пострадавших с ЧМТ [2]. В-третьих, созрела необходимость проводить индивидуализацию интенсивной терапии на основании многопараметрического нейромониторинга, с учетом тяжести и давности церебрального повреждения, возраста пострадавшего, сопутствующей соматической патологии, факторов вторичного повреждения головного мозга и т.д. [3,4].
Своевременность оказания нейрохирургического пособия, бесспорно, остается ведущим фактором, определяющим исход у пострадавших с ЧМТ. Декомпрессивная краниоэктомия — один из методов коррекции ВЧГ среди данной категории пострадавших, особенно при развитии внутричерепной гипертензии. К сожалению, сроки выполнения декомпрессивной краниоэктомии не определены. Использование различных стратегий: ранней «нейропротективной» или отсроченной декомпрессии — не показали убедительных преимуществ и не дали ожидаемого улучшения исходов при ЧМТ.
В предложенной работе показан совершенно новый подход, который можно назвать патофизиологическим, основанный на оценке ауторегуляции. По мнению авторов, срыв ауторегуляции мозгового кровотока является сигналом для выполнения декомпрессивной краниоэктомии. Это выглядит вполне обоснованным, так как при отсутствии ауторегуляции поддержание ЦПД на фоне внутричерепной гипертензии становится весьма проблематичным. На примере клинического случая авторам удалось наглядно показать клиническую ценность применения коэффициента ауторегуляции Prx у пациентов с тяжелой черепно-мозговой травмой. Результаты изложены четко и содержательно обсуждены в контексте современных публикаций на эту тему.
Представляется целесообразным дальнейшее исследование коэффициента ауторегуляции Prx, его внедрение в комплекс мер нейромониторинга у наиболее тяжелых категорий реанимационных больных и использование в качестве ориентира для целенаправленной терапии.
М.Ю. Киров (Архангельск)
В представленном клиническом наблюдении иллюстрируется роль скрининга маркеров воспаления и расширенного гемодинамического мониторинга в оптимизации интенсивной терапии пациента в остром периоде тяжелой черепно-мозговой травмы . Пациент поступил в отделение реанимации с диагнозом: «Острая тяжелая закрытая сочетанная черепно-мозговая травма». При поступлении уровень сознания оценивался по ШКГ 5 баллов. С первых суток пребывания в реанимации у пострадавшего отмечались гипертермия до 39,0º С, повышение С реактивного белка, лейкоцитоз, рентгенологические признаки аспирационной пневмонии. На вторые сутки для поддержания срАД не ниже 80 мм рт ст потребовалась инфузия норадреналина. На 10-е сутки состояние больного резко ухудшилось. Развилась гипертермия до 40,2º С, развилась сердечно-сосудистая недостаточность (на фоне вазопрессорной поддержки возникло резкое снижение АД до 49/20 мм рт ст). Начат расширенный гемодинамический мониторинг PiCCO (транспульмонарная термодилюция). Возникла необходимость ранней диагностики сепсиса. Стандартно используемые в работе отделения лабораторные исследования не соответствовали критериям септического шока. Отмечалось незначительное повышение CRP, а прокальциотонин (PCT) был в пределах нормальных величин. Диагностический поиск был дополнен исследованием интерлейкинов (IL-6 и IL-2R) в плазме крови. Было выявлено значительное повышение их значений, что можно было расценивать как начальные проявления системной воспалительной реакции. В результате состояние пациента было расценено как септическое. Была расширена антибактериальная терапия, начата продленная вено-венозная гемофильтрация. На фоне проводимой терапии состояние пациента стабилизировалось, у пациента восстановилось сознание в виде открывания глаз, выполнения простых инструкций. К моменту выписки состояние пациента по шкале исходов Глазго оценивалось в 4 балла.
Снижение артериального давления (АД) является ведущим фактором вторичного повреждения головного мозга у пациентов с тяжелой черепно-мозговой травмой (тЧМТ). Артериальная гипотензия (АГ) у пациентов с повышенным внутричерепным давлением (ВЧД) приводит к снижению церебрального перфузионного давления (ЦПД), что может привести к вторичной ишемии мозга. АГ требует незамедлительной коррекции, с учетом механизма её развития [1, 2,3]. В представленном клиническом наблюдении, у пациента с тЧМТ, осложнившейся септическим шоком, иллюстрируется роль расширенного гемодинамического мониторинга и скрининга маркеров воспаления в оптимизации интенсивной терапии (ИТ).
Пациент К., 42 года поступил в отделение реанимации Института нейрохирургии с диагнозом: «Острая тяжелая закрытая сочетанная черепно-мозговая травма, острая субдуральная гематома в правой лобно-теменно-височной области, ушиб головного мозга средней степени, травматическое субарахноидальное кровоизлияние, перелом чешуи височной кости слева; перелом левой ключицы». При поступлении уровень сознания оценивался по ШКГ 5 баллов. В ответ на болевой стимул отмечалось приведение в руках, разгибание в ногах, анизокория D>S, фотореакция вялая, кашлевой рефлекс угнетен. По данным компьютерной томографии головного мозга: справа в лобно-височно-теменной области определялась субдуральная гематома, срединные структуры смещены влево, желудочковая система и охватывающая цистерна компримированы. Также выявлялись признаки САК и перелом чешуи височной кости слева (рис.1).
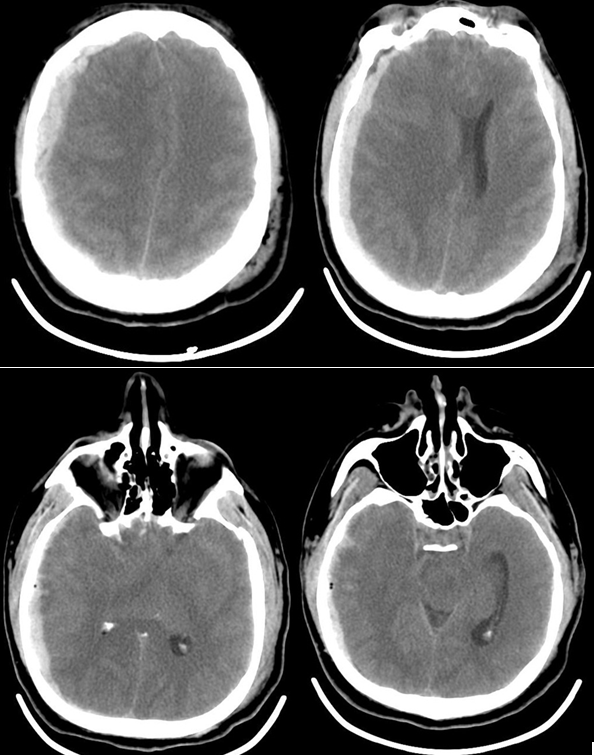
Рис. 1 КТ головного мозга пациента К., 42 года
Катетеризирована лучевая артерия, начат инвазивный мониторинг АД (монитор - Philips IntelliVue MP60). Системное АД без вазопрессорной и инотропной поддержки состовляло: АД – 145/88-160/90 мм рт.ст., ЧСС- 69-85 уд/мин. Дыхание аппаратное в режиме SIMV+PS, с параметрами вентиляции: tV- 0.7 l, RR-14, PS- 14 mbar, PEEP- 7 mbar, FiO2- 0.6, обеспечивающими нормовентиляцию по данным КОС артериальной крови. При фибробронхоскопии - признаки перенесенной аспирации.
После выполнения первичного диагностического поиска, было принято решение о хирургическом вмешательстве и выполнена «декомпрессивная трепанация черепа в правой лобно-теменно-височной области с удалением субдуральной гематомы». Операция была завершена установкой в премоторной области справа паренхиматозного датчика фирмы Codman для мониторинга ВЧД и контроля ЦПД (ЦПД=АДср-ВЧД). В течение последующих 10 суток, на протяжении всего острого периода, отмечались неоднократные подъемы ВЧД, максимально до 27 ммрт.ст., которые корректировали использованием гиперосмолярных растворов, углублением седации и обезболивания.
С первых суток пребывания в Институте у пострадавшего отмечались гипертермия до 39,0º С, повышение С реактивного белка до 125 мг/л, лейкоцитоз- 22.89 х 10 000000000/л (норма- <5 мг/л и 4.0-10.0 х 10 000000000/л соответственно) со сдвигом лейкоцитарной формулы влево, рентгенологические признаки аспирационной пневмонии (рис. 2).
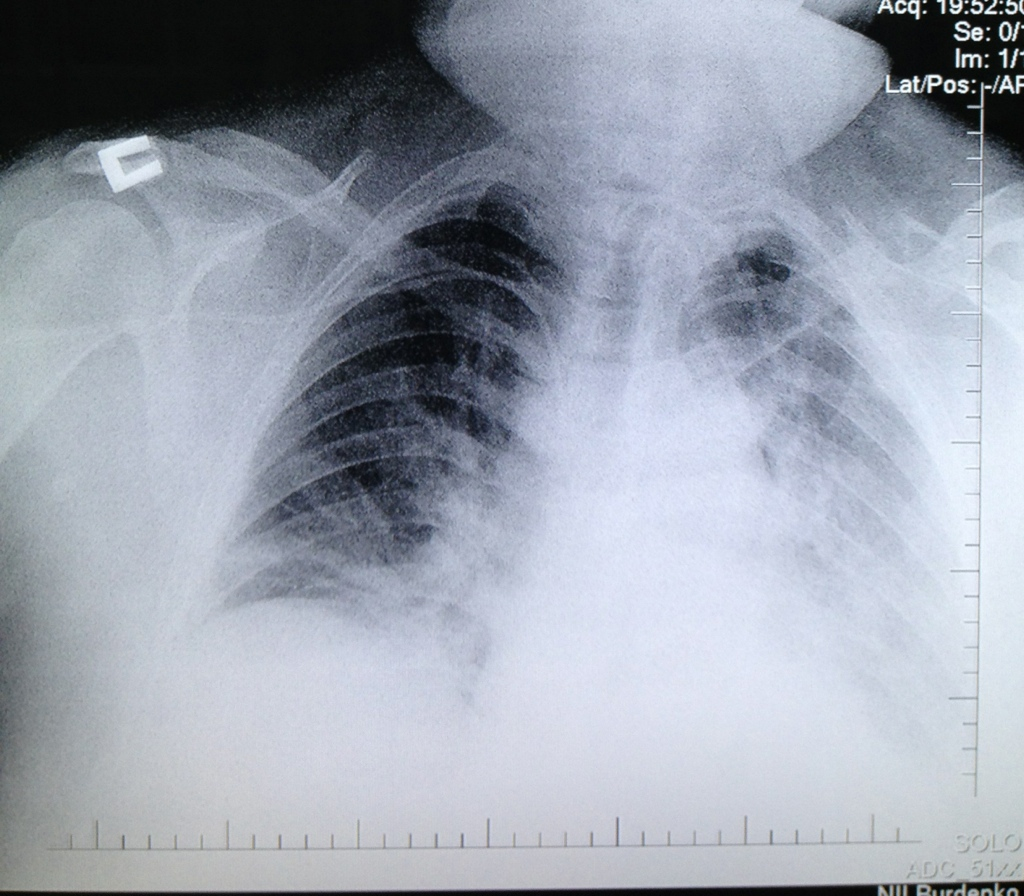
Рис. 2 Рентгенограмма органов грудной полости пациента К., 42 года
На вторые сутки для поддержания срАД не ниже 80 мм рт ст потребовалась инфузия норадреналина в дозе 0,1-1,3 мкг/кг/мин.
На фоне проводимой терапии к девятым суткам отмечалась стабилизация состояния пациента, при сохраняющейся умеренной гипертермии, снизился С реактивный белок до 33 мг/л; для поддержания гемодинамики требовались меньшие дозы норадреналина (0,22 мкг/кг/мин).
На 10-е сутки состояние больного резко ухудшилось. Развилась гипертермия до 40,2º С, выраженная десатурация капиллярной крови до 81-84%, при фракции кислорода во вдыхаемой смеси 100% (FiO2-1,0). Развилась сердечно-сосудистая недостаточность: несмотря на продолжающуюся постоянную инфузию норадреналина возникло резкое снижение АД до 49/20 мм рт ст. Для поддержания адекватного среднего АД (80 мм рт.ст) потребовалась комбинация симпатомиметиков: мезатон - 5,7 мкг/кг/мин и норадреналин в дозе 1,4 мкг/кг/мин. Также развилось нарушение деятельности желудочно-кишечного тракта: энтерально вводимая питательная смесь не усваивалась, сформировался пареза кишечника. В этот период ауторегуляция мозгового кровотока была сохранна, поэтому на фоне артериальной гипотензии, снижения ЦПД, увеличилось кровенаполнение мозга, развилась внутричерепная гипертензия, с эпизодами подъема ВЧД до 40 ммрт ст. В этой ситуации было необходимо провести дифференциальную диагностику между сепсисом, формированием диэнцефального синдрома, вторичной надпочечниковой недостаточностью, и первичным повреждением миокарда. Результаты ЭХО КГ не выявили перегрузку левых и правых отделов сердца, сократительная способность миокарда не была нарушена. С целью расширения гемодинамического мониторинга была использована методика PiCCO, с помощью монитора Philips IntelliVue MP60, в который интегрированы соответствующие блоки и программы. Калибровка проводилась каждые 6-8 часов введением 15 мл изотонического раствора NaCl, охлажденного до 8о С. Оценивали: показатели работы сердца - ударный объем (УО), сердечный выброс (СВ), сердечный индекс (СИ), общую фракцию изгнания (ОФИ); преднагрузку – ОПСС; волюметрические показатели- индекс общего конечно-диастолического объема сердца (ИОКДО), индекс внутригрудного объема крови (ИВГОК), индекс экстраваскулярной легочной жидкости (ИЭВЛЖ), индекс проницаемости легочных капилляров (ИПЛК), а также вариабельность ударного объема (ВУО) – как динамический показатель эффективности инфузионной терапии. Для оценки периферического кровотока использовался также индекс перфузии (ИП), который рассчитывается исходя из анализа плетизмографической волны. Дозы симпатомиметических препаратов подбирались с учетом данных, получаемых в результате расширенного мониторинга параметров системной гемодинамики.
При исследовании гормонального профиля был исключен клинически значимый дефицит кортизола, тиреоидных гормонов, АКТГ в плазме крови. Стандартно используемые в работе отделения лабораторные исследования не соответствовали критериям септического шока. Так, отмечалось незначительное повышение CRP, а прокальциотонин (PCT) был в пределах нормальных величин, при умеренно выраженном лейкоцитозе (13х109, без сдвига лейкоцитарной формулы влево). Диагностический поиск был дополнен исследованием интерлейкинов (IL-6 и IL-2R) в плазме крови. Было выявлено значительное повышение их значений >6000 пг/мл и 2805 Е/мл (норма: 0.0-5.9 пг/мл и 158-623 Е/мл соответственно), что можно было расценивать как начальные проявления системной воспалительной реакции.
В результате состояние пациента было расценено как септическое. Была расширена антибактериальная терапия, начата продленная вено-венозная гемофильтрация (ПВВФ). Взяты биологические среды на микробиологический анализ (на вторые сутки культивирования был выявлен рост Грамм (-) возбудителя в посевах крови).
На фоне проводимой терапии состояние пациента стабилизировалось: удалось корректировать артериальную гипотензию, добиться необходимого ЦПД, что привело к нормализации ВЧД. В течение последующих двух суток, температура тела нормализовалась до 36,0º С, удалось уменьшить дозы симпатомиметиков в 2-3 раза, снизить FiO2 c 1.0 до 0.6, у пациента восстановилось сознание в виде открывания глаз, выполнения простых инструкций. На момент перевода пациента из Институте в реабилитационный центр оценка по ШИГ – 4 балла.
В представленном клиническом наблюдении иллюстрируется роль скрининга маркеров воспаления и расширенного гемодинамического мониторинга в оптимизации ИТ пациента в остром периоде т ЧМТ. Бактериальные инфекции и сепсис являются основной причиной заболеваемости и смертности в ОРИТ [4, 5]. Не вызывает сомнений тот факт, что высокая смертность от сепсиса во многом обусловлена его поздней диагностикой и неэффективным мониторингом проводимого лечения. Клинические и лабораторные признаки системной воспалительной реакции, такие как лихорадка, тахикардия, тахипноэ и лейкоцитоз, могут быть результатом неинфекционных причин. С этих позиций особый интерес представляет поиск надежных и ранних маркеров системной воспалительной реакции. Если сравнивать чувствительность таких маркеров септической реакции как CRP (Ц-реактивный протеин), PCT (прокальцитонин) и IL-6 (интерлейкин-6), то по данным мировой литературы большинство авторов ставят на первое место прокальцитонин, далее интерлейкины и затем С-реактивный белок [6, 7]. Но, необходимо понимать, что в каждом конкретном случае нужно комплексно оценивать степень выраженности инфекционного процесса и его локализацию. В литературе описаны случаи, когда концентрация прокальцитонина не возрастала или возрастала в малой степени при тяжелых вирусных инфекциях или воспалительной реакции неинфекционной природы. [8, 9]. Также, доказано, что прокальцитонин не определяется или его уровень очень низок при изолированной пневмонии, но чрезвычайно высок при пневмонии и сепсисе. Что касается IL-6 – большинство авторов ставят его на второе место после прокальцитонина по чувствительности и специфичности в диагностике сепсиса. В приведенном клиническом наблюдении на 10-е сутки состояние больного резко ухудшилось, развилась сердечно-сосудистая недостаточность, артериальная гипотензия, резистентная к стандартным дозам симпатомиметических препаратов, в сочетании с выраженной устойчивой гипертемией. Артериальная гипотензия, снижение ЦПД, сочетались с эпизодами подъема ВЧД до 40 ммрт ст. В этой клинической ситуации была необходима экстренная дифференцировка между сепсисом, формированием диэнцефального синдрома, вторичной надпочечниковой недостаточностью, и первичным повреждением миокарда.
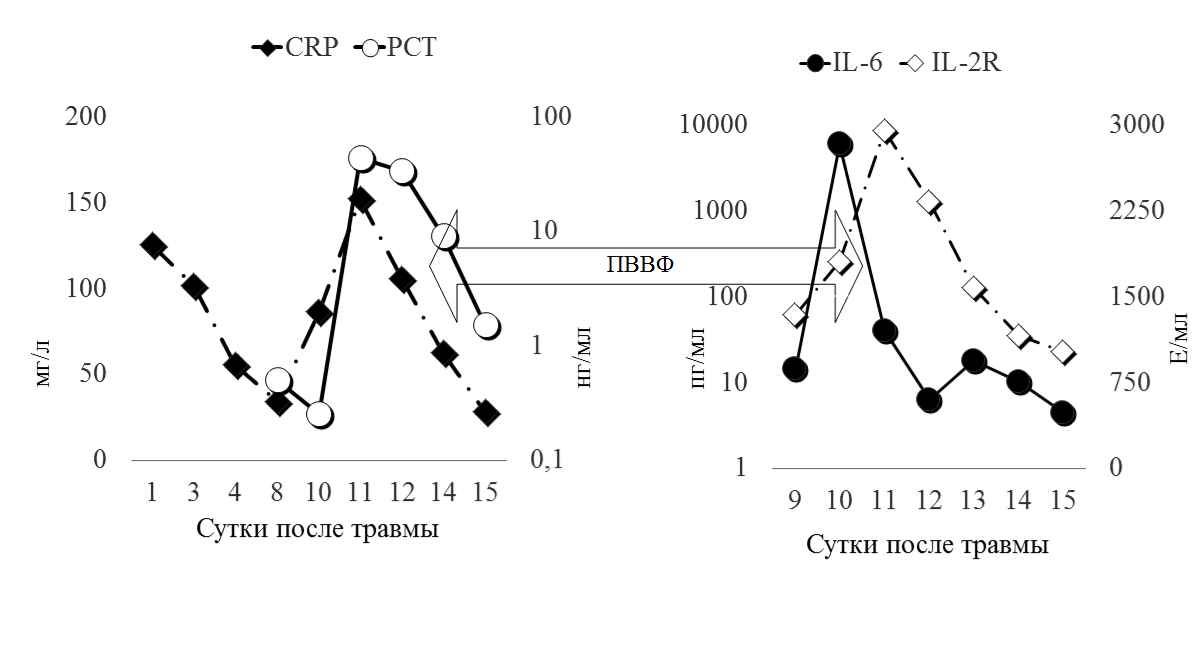
Рис. 3 Динамика маркеров воспаления
Представленный на рисунке 3 график демонстрирует отсроченную реакцию CRP и РСТ на манифестацию инфекционного процесса, их повышение отмечалось лишь через 48 часов, от развития клиники септического шока, тогда как интерлейкины, незамедлительно отреагировали на септицемию. График также демонстрирует эффективность ПВВФ в элиминации провоспалительных цитокинов из плазмы крови.
При яркой клинической картине сепсиса не было получено его подтверждения «стандартными» лабораторными методами (PCT, CRP, лейкоцитарная формула). Диагностический поиск был незамедлительно дополнен исследованием интерлейкинов, что позволило сократить время до начала патогенетической терапии. У данного пациента, именно IL-6, оказался наиболее быстрым и информативным показателем развития и выраженности септического процесса. Приводимое клиническое наблюдение наглядно демонстрирует необходимость всесторонней оценки инфекционного процесса. Все это говорит о необходимости проводить дальнейшие исследования по сравнению чувствительности различных маркеров системной воспалительной реакции и сепсиса.
Необходимо отдельно остановиться на состоянии системной гемодинамики.
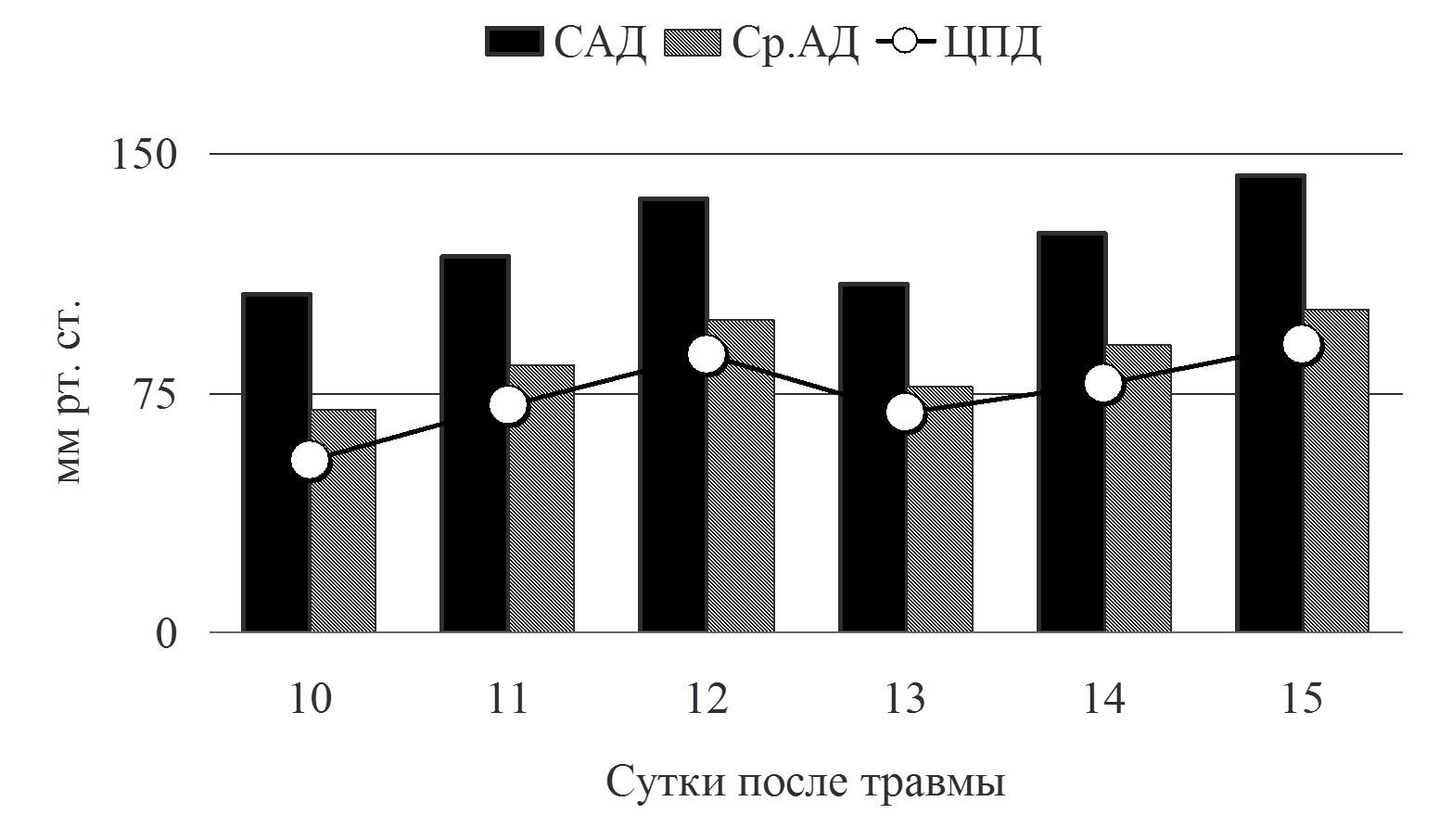
Рис.4 Динамика давления
Как видно из графика на рис. 4, мы поддерживали систолическое и среднее АД на достаточно высоких цифрах, что противоречит современным рекомендациям по терапии сепсиса. Тому есть свое объяснение. Последние международные рекомендации по ведению пациентов с тЧМТ подчеркивают необходимость мониторинга АД и предупреждения артериальной гипотензии. При этом артериальной гипотензией считается снижение систолического артериального давления ниже 90 мм рт. ст. (рекомендации второго уровня). Там же приводятся данные демонстрирующие ухудшение результатов лечения при снижении Ср. АД ниже 80 мм рт ст [10]. Высокие цифры среднего АД, обеспечивали ЦПД выше 60 мм рт. ст., что было необходимо для поддержания адекватного объемного мозгового кровотока, у пациента в остром периоде тЧМТ, осложненной отеком мозга. Как же поддерживались необходимые параметры системной гемодинамики в анализируемом клиническом наблюдении? Адекватность терапии, направленной на поддержание необходимого артериального давления, обеспечивалась расширенным гемодинамическим мониторингом PiCCO (транспульмонарная термодилюция).
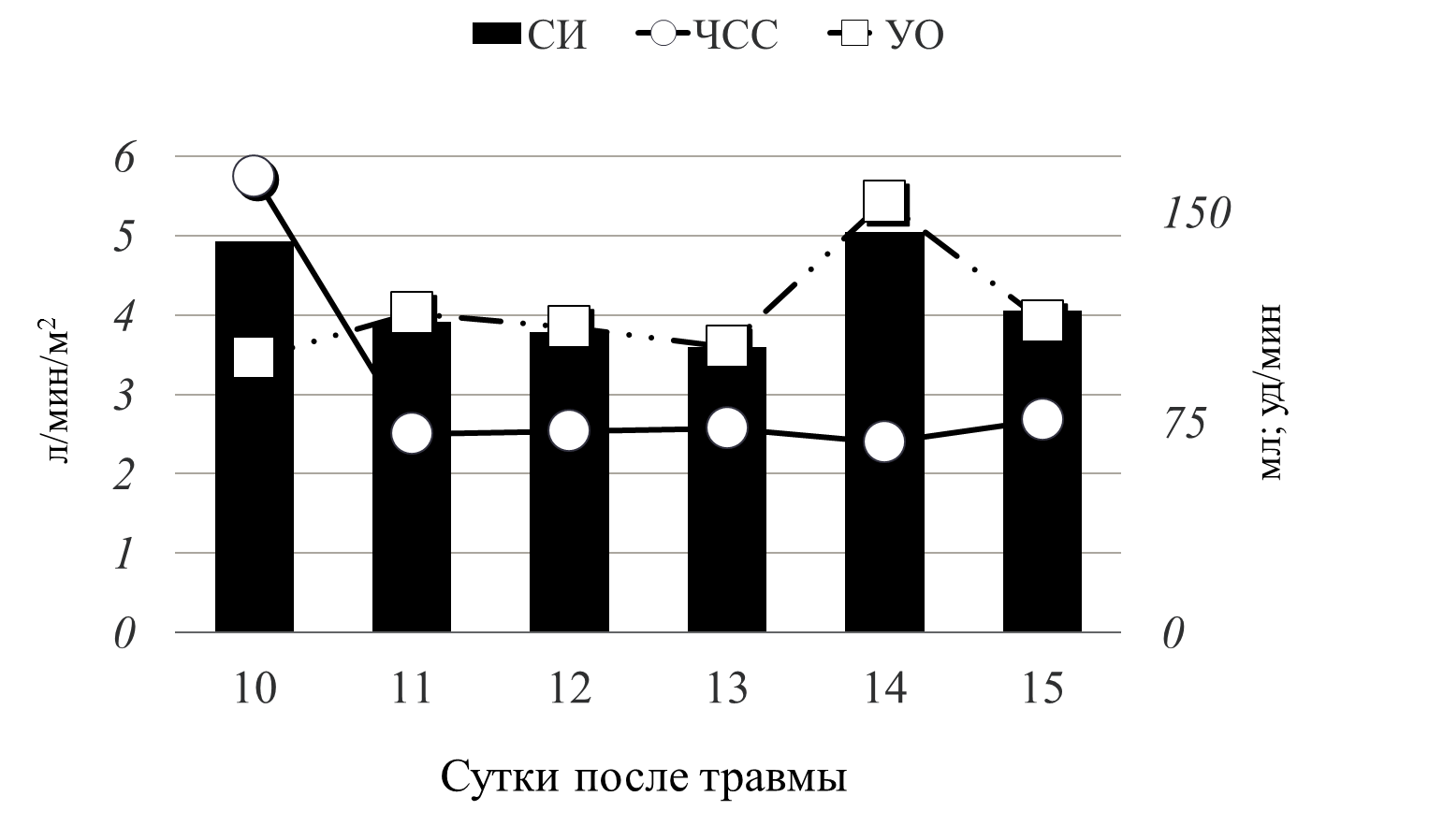
Рис 5 динамика СИ
График демонстрирует динамику сердечного индекса (рис.5). В течение первых суток септического шока нормальный уровень СИ поддерживался за счет выраженной тахикардии (ЧСС до 167 уд/мин) при низком ударном объеме - 87,6 мл. На фоне проводимой терапии мы добились нормализации сердечного ритма 80-83 уд/мин, при этом СИ поддерживался уже за счет адекватного УО – 160 мл.
Одним из методов поддержания необходимого среднего АД было применение симпатомиметиков (рис. 6).
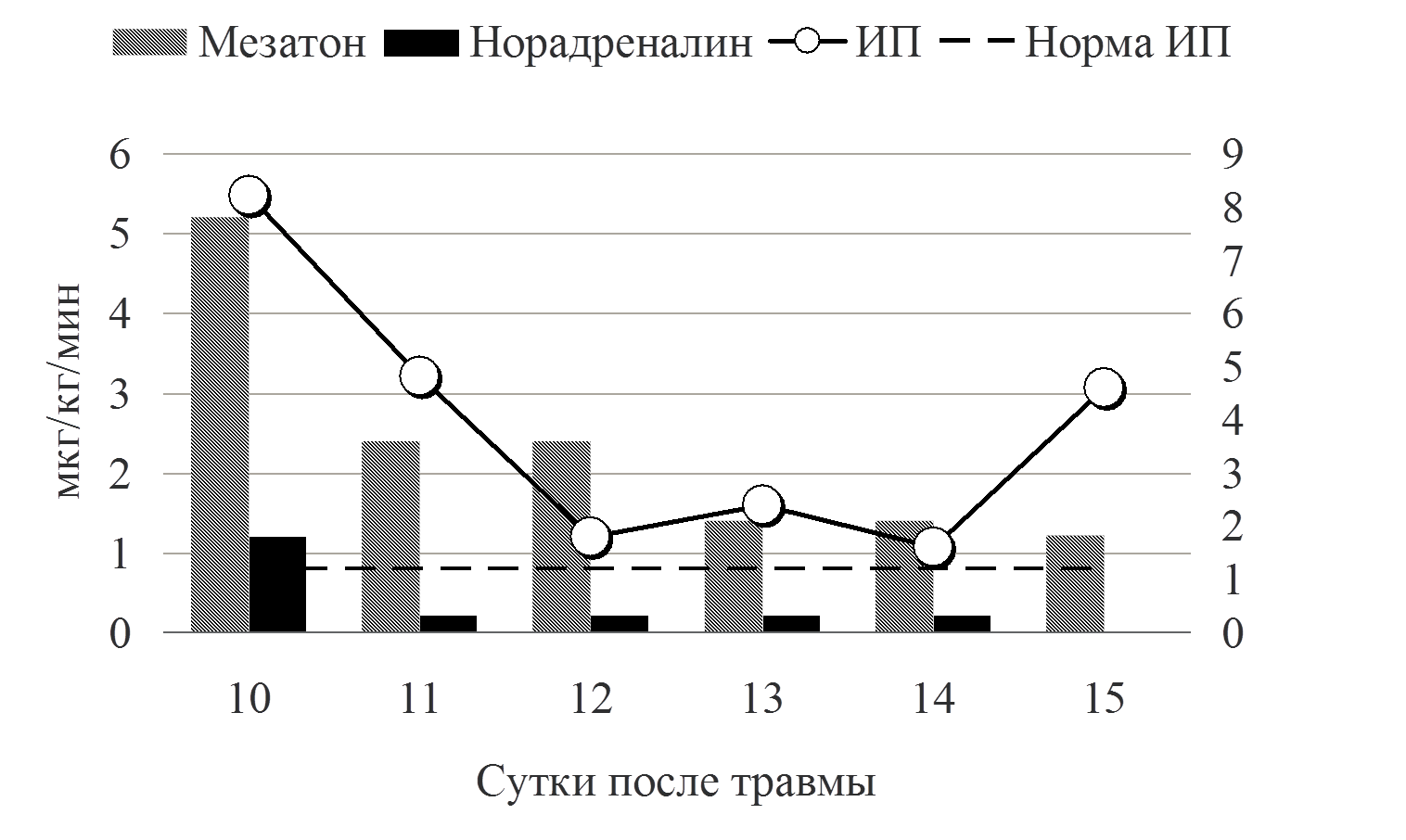
Рис. 6 Применение симпатомиметиков
В приводимом клиническом наблюдении требовалось сочетание двух препаратов мезатон (фенилэфрин) и норадреналин в высоких дозировках. Безопасность применения вазопрессоров контролировалась двумя показателями гемодинамики ОПСС и индексом перфузии (ИП). Из графика видно, что применение высоких доз симпатомиметоков не приводило к нарушению периферической циркуляции крови. Так, на начальном этапе при применении мезатона и норадреналина в дозировке 5,7 мкг/кг/мин и 1,4 мкг/кг/мин, соответственно, выявлялись относительно низкие цифры ОПСС (830 DSм2/см5) и высокий показатель ИП - 8. В дальнейшем в процессе терапии комбинацией симпатомиметиков ИОПСС не превышал физиологической границы (2000 DSм2/см5), а индекс перфузии не был ниже 1,2. Другим важным компонентом поддержания адекватных показателей системной гемодинамики является инфузионная терапия. При выборе тактики увеличения либо снижения темпа инфузионной терапии мы ориентировались на статические (ЦВД, ИВГОК) и динамические (ВУО) показатели волемии (рис.7).
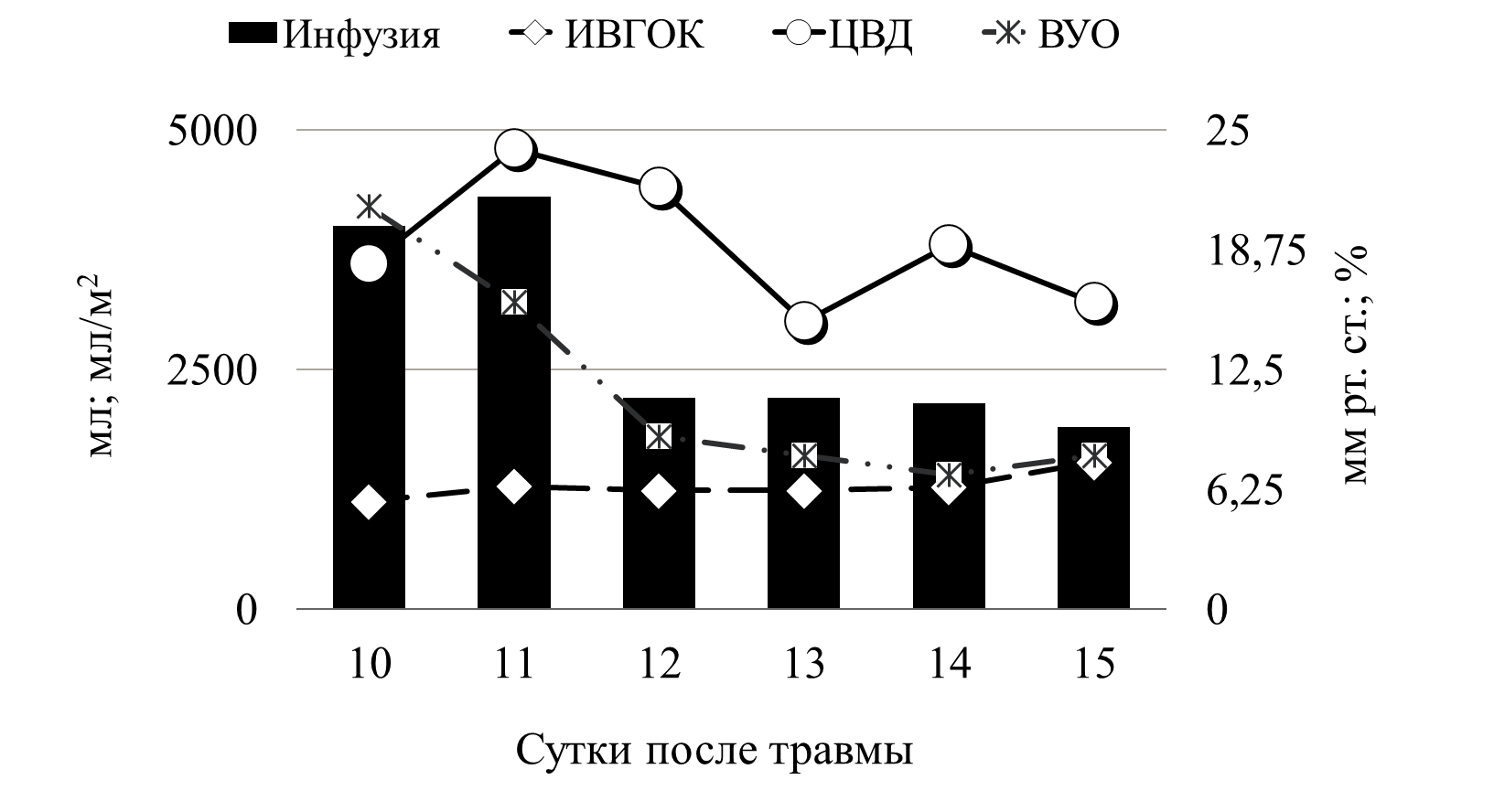
Рис. 7 Инфузионная терапия
На представленном графике видно, что с первых дней сепсиса статические показатели волемии были выше принятых нормальных значений, однако мы повышали темп и объем инфузионной терапии, ориентируясь на динамический показатель волемии. Как указывалось выше, у пациентов с тЧМТ критическим моментом является предупреждение артериальной гипотензии. В обсуждаемом клиническом наблюдении для поддержания адекватного АД при развитии септического шока было необходимо использовать два симпатомиметка: норадреналин и мезатон. В настоящее время, так и не сложилось однозначного отношения к выбору симпатомиметических препаратов для коррекции артериальной гипотензии у пациентов с тяжелым сепсисом. Несмотря на то, что в «Руководстве по ведению пациентов с тяжелым сепсисом и септическим шоком» препаратами выбора считаются допамин и норадреналин, ряд авторов получили достаточно противоречивые результаты при использовании этих препаратов [11]. Так Azarov et al выявил связь между применением допамина и увеличением смертности при септическом шоке [12]. Backer et al., не нашел никаких существенных различий в летальности между пациентами, получавшими допамин и норадреналин, однако отметил большее число побочных эффектов при применении допамина [13]. Gaurav Jain and D. K. Singh, показали, что мезатон сопоставим с норадреналином в коррекции гемодинамических и метаболических нарушений при сепсисе [14]. Shenoy et al., проведя мета-анализ применения допамина и норадреналина у пациентов с тяжелым сепсисом, пришли к выводу, что при наличии тех или иных гемодинамических преимуществ каждого, нельзя говорить о превосходстве одного симпатомиметика над другим [15]. В приведенном клиническом наблюдении выбор препарата основывался на данных расширенного мониторинга и выявлении причины снижения АД. Было выявлено, что у пациента на фоне сохраненной сократительной способности миокарда (адекватная фракция изгнания и высокие цифры ВОУ) отмечался вазопаралич (низкое ОПСС и высокий показатель ИП). Для нормализации этих показателей, было необходимо применять комбинацию мезатона с норадреналином. Высокие дозы этих препаратов применяли, используя ОПСС и ИП как критерии безопасности проводимой вазопрессорной терапии. Это позволило избежать выраженной вазоконстрикции и нарушения периферического кровотока. Необходимо отдельно остановиться на ИП. Этот показатель, достаточно широко обсуждаемый в англоязычной литературе, незаслуженно, на наш взгляд, обделен вниманием отечественными авторами. ИП рассчитывается исходя из анализа плетизмографической волны. Она состоит из двух компонентов обозначаемых как DC и AC. DC - это непульсирующий компонент плетизмографического сигнала (от венозной и нециркулирующей артериальной крови), а AC – пульсирующий компонент пульсовой вольны (от пульсирующей артериальной крови). ИП рассчитывается как AC/DC × 100%, и автоматически выводится на большинство прикроватных мониторов [16]. Высокие показатели этого индекса говорят о вазодилятации. А низкие о выраженной вазоконстрикции, в том числе и при избыточном применении симпатомиметиков, либо в сочетании с выраженной гиповолемией [16]. ИП позволяет не только диагностировать нарушение микроциркуляции конечностей, но и прогнозировать нарушение спланхнического кровотока [17,18,19 ]. Таким образом, данные расширенного гемодинамического мониторинга, мониторинга периферического кровообращения позволили использовать у пациента К., с тЧМТ, осложнённой септическим шоком, высокие дозы вазопрессоров для поддержания адекватного ЦПД без нарушения микроциркуляции и развития полиорганной недостаточности.
Дополненный исследованием интерлейкинов стандартный скрининг маркеров воспаления в сочетании с расширенным гемодинамическим мониторингом способствовали своевременному проведению патогенетической терапии с учетом индивидуальных характеристик гемодинамического профиля у пациента с тяжелой черепно-мозговой травмой, осложненной септическим шоком. Проведенная терапия обеспечила адекватную церебральную перфузию, без ущерба для микроциркуляции во внутренних органах, что позволило добиться регресса неврологической симптоматики и избежать развития полиорганной недостаточности.