Внутрибольничные, или нозокомиальные инфекции (НИ), развивающиеся в непосредственной связи с оказанием медицинской помощи, представляют серьезную проблему для современного здравоохранения, поскольку приводят к дополнительной заболеваемости, повышению летальности, удлинению сроков лечения и увеличению его стоимости [1—3].
В силу объективных причин частота возникновения НИ у пациентов отделений реанимации составляет 20—25%, что существенно выше по сравнению с другими отделениями стационаров [4]. К основным факторам риска относят: более частую необходимость использования инвазивных устройств и методик; непосредственную тяжесть состояния пациентов отделений реанимаций и степень органных повреждений; нарушение иммунного статуса у больных в критических состояниях; необходимость широкого использования антибактериальной терапии, способствующей селекции полирезистентных патогенов — возбудителей НИ [2, 5, 6].
Особенностями оказания медицинской помощи при нейрохирургической патологии являются: нарушение защитных барьеров головного мозга при проведении оперативных вмешательств, их большая продолжительность, а также применение методов инвазивного нейромониторинга. Частота инфекционных осложнений центральной нервной системы (ЦНС) ожидаемо отличается от таковых в стационарах общехирургического профиля.
В результате эпидемиологического наблюдения, проведенного в 2009 г. в отделении реанимации НИИ нейрохирургии им. акад. Н.Н. Бурденко, было выявлено, что в структуре НИ менингиты занимают 3-е место после инфекций нижних дыхательных путей (ИНДП) и мочевыделительных путей (ИМВП).
Основными факторами риска развития внутрибольничных менингитов по данным литературы [7—11], считаются внутрижелудочковое кровоизлияние, краниотомия, раневая ликворея, длительность нейрохирургической операции и наружного вентрикулярного дренирования со значительным повышением риска присоединения инфекции после 5 дней нахождения дренажа. Значимую роль также играют вентрикуло-перитонеальное шунтирование, наличие датчика внутричерепного давления (ВЧД) и повторное нейрохирургическое вмешательство [11].
Цель данного исследования
— установление частоты развития НМ и их клинико-эпидемиологических особенностей у пациентов отделения нейрореанимации.
Материал и методы
Исследование велось в отделении реанимации НИИ нейрохирургии им. акад. Н.Н. Бурденко с октября 2010 г. по январь 2014 г. В проспективное наблюдение включены все пациенты, госпитализированные в отделение реанимации на период более 48 ч. Ежедневно проводили регистрацию особенностей соматического, неврологического статуса больных, признаков инфекционного процесса (системной воспалительной реакции) и факторов риска, таких как наличие наружного вентрикулярного дренажа, датчика ВЧД, ИВЛ, центрального венозного катетера и др. [3].
Результаты вносили в специально разработанную базу данных, интегрированную в электронную историю болезни пациента. Для диагностики инфекций ЦНС (ИЦНС) использовали общепринятые определения случаев (Definitions of Nosocomial Infections), разработанные Центрами по контролю заболеваемости США (Centers for Disease Control) [12].
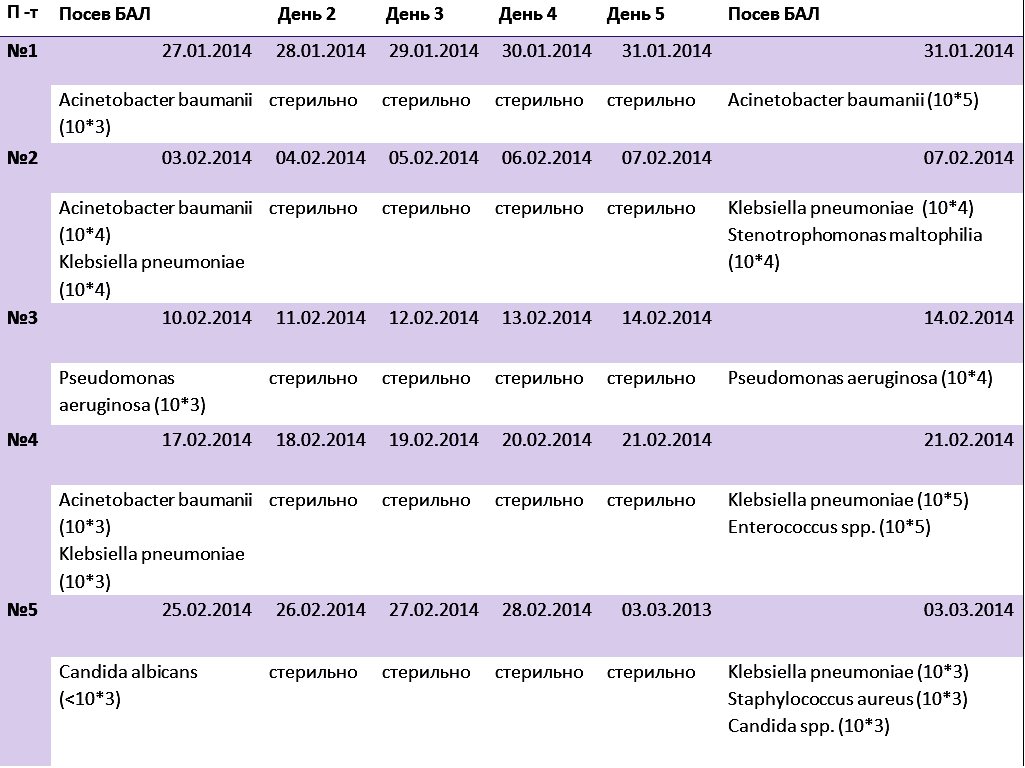
За указанный период всего в ОРИТ были госпитализированы 8062 пациента. Осложненное течение заболевания, потребовавшее пребывания в реанимации более 48 ч, наблюдалось у 1153 (14,3%) больных. Информация об этих пациентах была систематизирована и внесена в базу данных. Клинический диагноз «менингит» выставлен 146 пациентам, что составило 12,6±1,0% (доверительный интервал 10,74—14,66). Критериями такого диагноза являлись: нейтрофильный цитоз ликвора (количество клеток в камере) более 150/3, уровень глюкозы ликвора более 50% от глюкозы крови, высев патогена из ликвора, признаки системной воспалительной реакции (SIRS-синдром), появление менингеальных симптомов, развитие отрицательной динамики в неврологическом статусе [12].
Возраст в группе больных с менингитами колебался от 4 мес до 88 лет (средний возраст 37,6 года). Доля пациентов детского возраста (до 18 лет) была одинаковой в группах как заболевших, так и незаболевших больных.
Для большинства пациентов с менингитами была характерна супратенториальная локализация патологического процесса (72,8±3,7%). У 20,4% обследованных наблюдалась патология задней черепной ямки. Распространение патологического процесса на супра- и субтенториальные области отмечалось у 5,4% пациентов, и только 1,4% больных с менингитами имели спинальный уровень повреждения (грудной отдел позвоночника) (рис. 1).
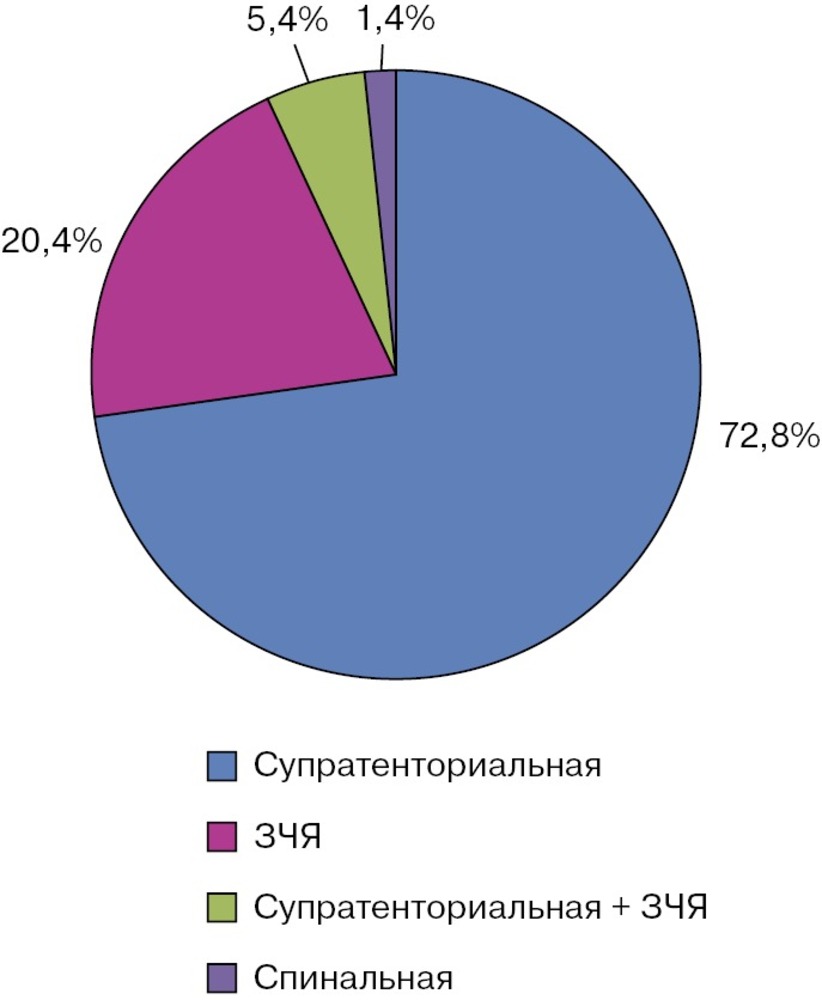
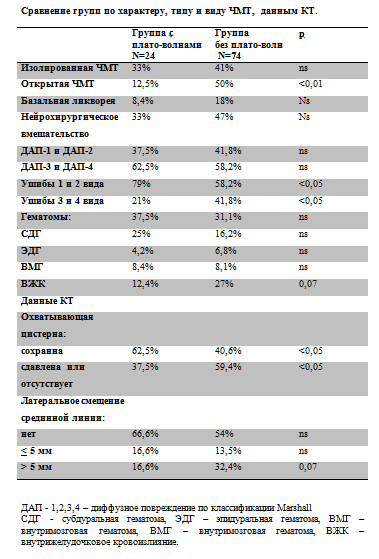
Примечание. ЗЧЯ — задняя черепная ямка. Структура нейрохирургической патологии у пациентов с менингитами была представлена: опухолями различной локализации — 67,3%, черепно-мозговыми травмами (ЧМТ) — 13,6%, артериальными аневризмами и артериовенозными мальформациями (АВМ) сосудов головного мозга — 11,6% (рис. 2). Доля пациентов с острой ЧМТ в обеих группах была сопоставимой.
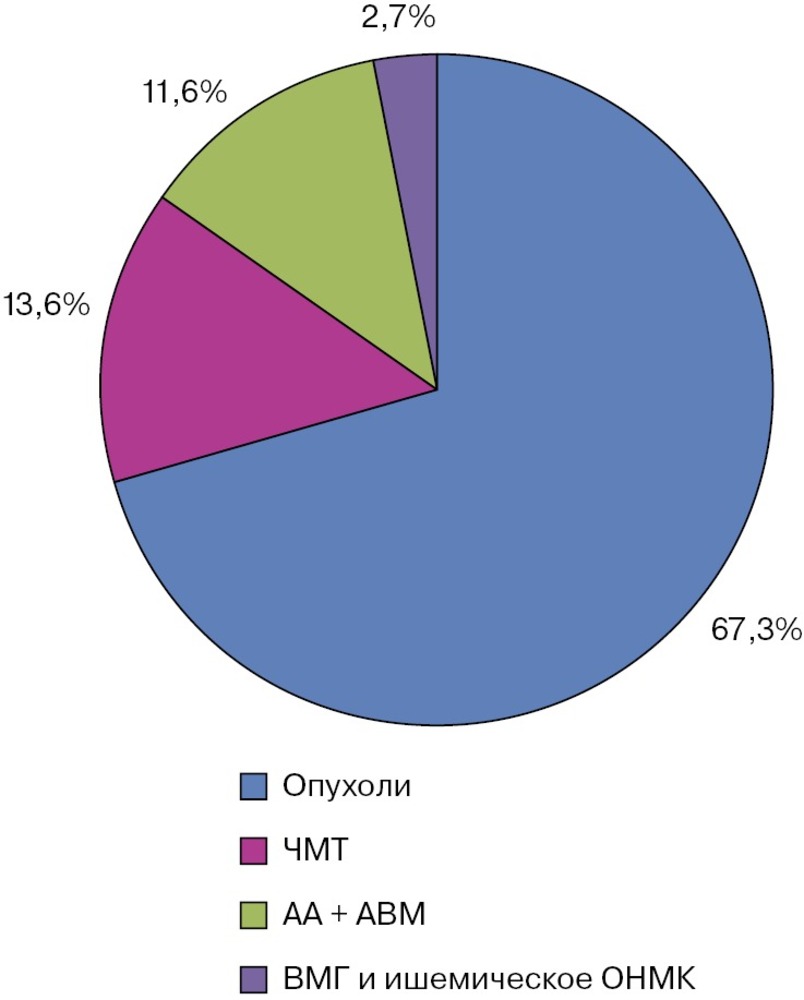
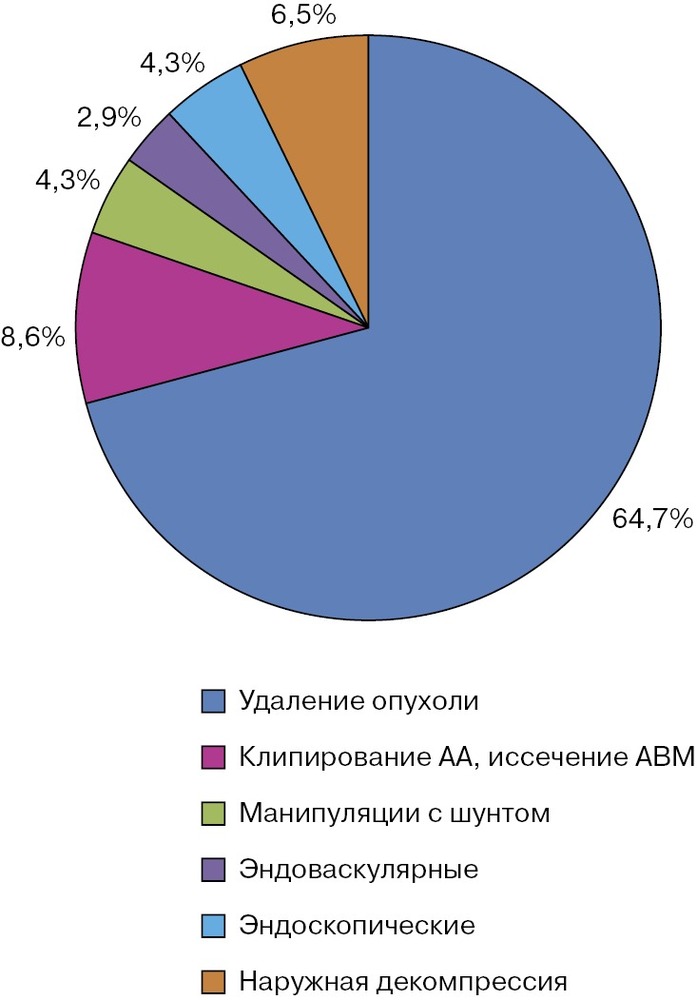
Примечание. Здесь и на рис. 3: АА — артериальные аневризмы головного мозга, АМВ — артериовенозные мальформации головного мозга, ВМГ — внутримозговые гематомы, ОНМК — острое нарушение мозгового кровообращения. По тяжести общего состояния на момент госпитализации в НИИ нейрохирургии им. акад. Н.Н. Бурденко пациенты распределились следующим образом: 34 (23,1%) больных поступили с максимальной степенью инвалидизации (40 баллов и ниже по шкале Карновского), 92 (62,6%) — в компенсированном состоянии. Для оценки прогноза больных с длительными сроками наблюдения использовался индекс коморбидности Charlson [13], отражающий сопутствующую соматическую патологию и возраст. У пациентов с НМ он варьировал от 0 до 10 баллов, составляя в среднем 3 балла.
Прооперированы 139 пациентов (94,6±1,9%). У 90 (64,7%) пациентов удалены опухоли головного мозга различной локализации, при этом у 1 больного опухолевый процесс сочетался с сосудистой патологией — множественными артериальными аневризмами. Иссечение АВМ и клипирование интракраниальных аневризм осуществили у 12 (8,6%) больных. Декомпрессивная трепанация как основное нейрохирургическое вмешательство (в основном при ЧМТ) выполнена в 6,5% случаев. Реже в группе пациентов с менингитами проводились эндоскопические, эндоваскулярные и шунтирующие операции (рис. 3).
В структуре осложнений в отделении реанимации преобладали: раневая ликворея (34±3,9%), диастаз краев раны (17,7±3,1), гематомы в зоне оперативного вмешательства, по поводу последних у 18 пациентов (12,2±2,7%) была выполнена ревизия операционной раны.
Сроки нахождения больных с менингитами в ОРИТ составили от 1 до 167 дней (в среднем 40 койко-дней), при этом повторное поступление в реанимацию наблюдалось у 57 пациентов (38,8±4,0%).
Для обработки данных использованы методы параметрической и непараметрической статистики, дисперсионный анализ, анализ частот сопряженности, в основном — статистический пакет Statistica v. 6 и комплекс программ по книге Стентона Гланца «Медико-математическая статистика»[14].
Результаты и обсуждение
Частота развития менингитов в группе осложненных нейрохирургических пациентов за 3 года составила 12,6±1,0% (ДИ 10,74—14,66), летальность в группе больных с менингитами составила 31,5±3,8%.
Этиология менингита установлена в 89 (61,0±4,0%) из 146 случаев. Абсолютное число выделенных патогенов (грамположительных, грамотрицательных и грибов рода Candida) в группе больных с менингитами установленной этиологии равнялось 103 (см. таблицу). Превалирующими возбудителями в нашем исследовании оказались: грамположительные кокки, в том числе коагулазонегативный стафилококк (CoNS) (33,0±4,6% от числа общих патогенов), а также грамотрицательные бактерии (32,0±4,6%). При этом доля Acinetobacter baumannii в качестве этиологического агента НМ составила 21,3±4,0%.
Структура патогенов, выделенных из материала от больных с гнойными менингитами
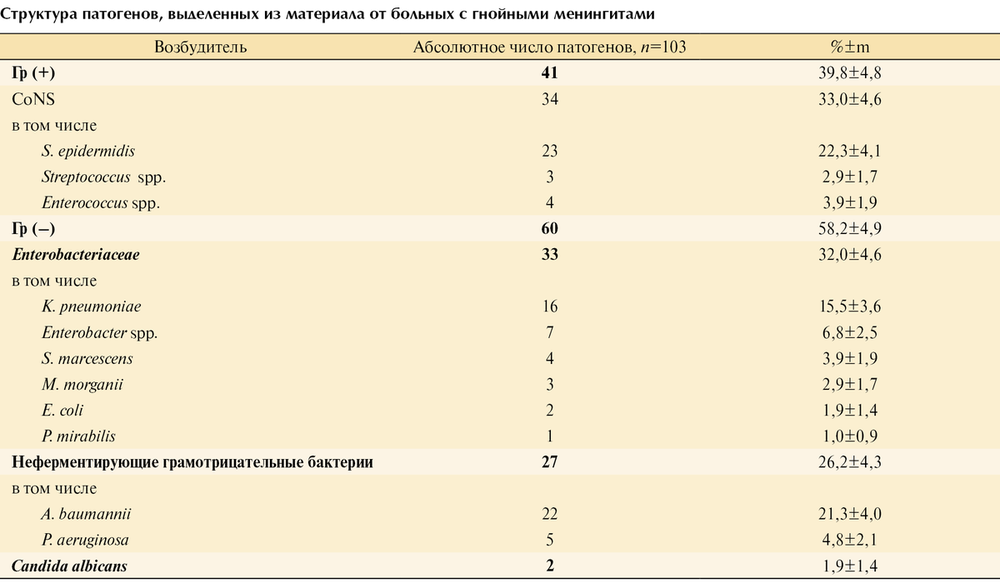
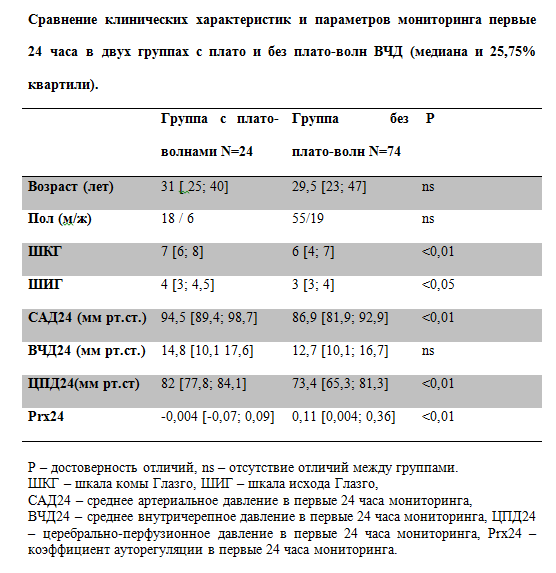
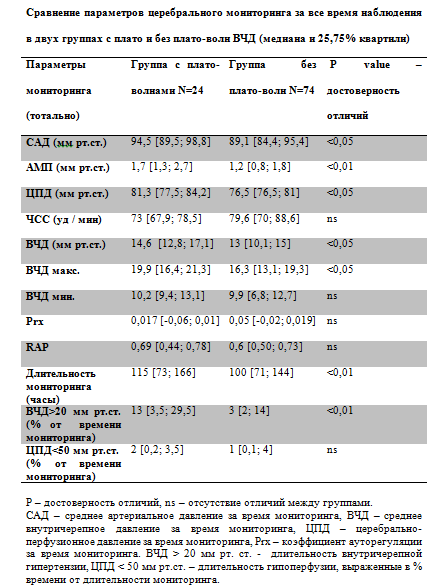
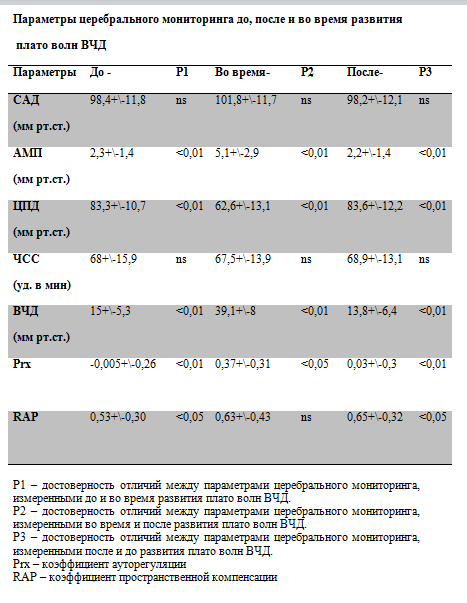
При анализе групп заболевших и незаболевших пациентов выявлено, что средний возраст (37,6 года) больных с инфекцией ЦНС был существенно меньше возраста пациентов без инфекции ЦНС (42,4 года). В группе пациентов без менингита распределение по полу было приблизительно одинаковым, в отличие от пациентов с менингитом, где было достоверно больше мужчин. Индекс Charlson оказался меньше в исследуемой группе (3 балла vs. 3,4 балла) в сравнении с контрольной. Больные с менингитами характеризовались более длительной госпитализацией в ОРИТ (на 22,9 дня дольше), пролонгированной ИВЛ (на 21,4 дня больше), необходимостью в центральном венозном доступе (на 24,5 дня), катетеризации мочевого пузыря, питании через назогастральный зонд, а также более продолжительным курсом антибактериальной терапии (на 20,1 дня). В группе заболевших НМ чаще использовали инвазивный мониторинг системной гемодинамики (42,2%) по сравнению с группой незаболевших (29,7%; р<0,003). Частота мониторинга ВЧД не имела отличий в этих двух группах пациентов. Среди больных с менингитами в сравнении с незаболевшими чаще выявляли инфекции кровотока (14,8% vs. 4,9%; р<0,000), дыхательной (55% vs. 35,6%; р<0,000) и мочевыделительной систем (56,4% vs. 30,9%; р<0,000). Установлены достоверные отличия в группах заболевших и незаболевших: в более частом использовании наружного вентрикулярного дренирования (72,5 и 26,1% соответственно; р<0,000); числе повторных операций (64,7 и 36,3%; р<0,000); суммарном времени, проведенном пациентами в операционной (417,3 и 337,5 мин соответственно; р<0,000).
Таким образом, факторы риска развития НМ условно можно разделить на внутренние и внешние. К первым относятся: возраст, пол, тяжесть состояния больного на момент манифестации у него нейрохирургического заболевания и характер данного заболевания. Основными внешними факторами риска, по данным литературы [7—11, 15], считают наружное вентрикулярное дренирование, шунтирующие операции, развитие ликвореи, наличие датчика ВЧД и повторное нейрохирургическое вмешательство.
В нашем исследовании заболевшие пациенты отличались более молодым возрастом (несмотря на то что доля детей в обеих группах статистически не различалась) и низким индексом коморбидности Charlson, что может косвенно указывать на меньшую сопутствующую патологию у этой категории больных. Аналогичные данные приведены в зарубежных работах по НМ [16]. При этом заболевшие пациенты более длительно находились в ОРИТ с применением соответствующих инвазивных устройств, в том числе пролонгированной ИВЛ, и достоверно чаще подвергались нейрохирургическим вмешательствам (наружное дренирование, повторные операции). Примечательно, что мы не получили убедительного влияния инвазивного мониторинга ВЧД на частоту развития менингитов.
Таким образом, в этиологии развития НМ у пациентов отделения реанимации доказанным оказалось превалирование внешних факторов риска, что может говорить об экзогенном характере инфицирования. Наличие инфекций другой локализации можно считать дополнительным фактором тяжести состояния больных с менингитами.
Заключение
Менингиты в нейрохирургии представляют серьезную проблему, приводя к удлинению сроков лечения, увеличению потребности в антибактериальных препаратах и существенно ухудшая прогноз заболевания. К факторам риска развития НМ у больных в ОРИТ можно отнести наружное вентрикулярное дренирование, повторные операции, длительность нахождения в операционной, а также наличие у пациентов инфекций другой локализации.
Комментарий
В статье проведен анализ влияния внутренних (возраст, пол, исходная тяжесть состояния больного) и внешних (наружное вентрикулярное дренирование, шунтирующие операции, краниотомии, ликворея, повторные нейрохирургические вмешательства) факторов риска на частоту развития внутрибольничных менингитов у пациентов отделения нейрореанимации. Было доказано преобладание внешних факторов риска, что говорит о преимущественно экзогенном характере инфицирования больных.
Актуальность статьи не вызывает сомнения, поскольку менингиты занимают третье место после инфекций нижних дыхательных путей и мочевыделительных путей в структуре НИ в отделениях нейрохирургического профиля. Развитие НМ определяет большую длительность госпитализации в ОРИТ и значительно увеличивает сроки стационарного лечения.
Особенностью подхода авторов к сбору информации для исследования является проведение проспективного обсервационного исследования с использованием значительной базы данных, включающей 1153 пациента. Примечательно, что диагностика внутрибольничных инфекционных осложнений со стороны центральной нервной системы проводилась с применением наиболее современных подходов, были использованы стандартные определения случаев (Definitions of Nosocomial Infections, CDC, США).
Научная статья авторов Н.В. Курдюмовой, Г.В. Данилова, О.Н. Ершовой, И.А. Савина, Е.Ю. Соколовой, И.А. Александровой, М.А. Шифрина «Особенности развития внутрибольничных менингитов у пациентов отделения нейрореанимации» выполнена на высоком научном уровне и содержит выводы, представляющие практический интерес. Источники, цитируемые в настоящей статье, отражают современную точку зрения на исследуемую проблему.
В.В. Кулабухов (Москва)
Список литературы:
- Козлов Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль. Клиническая микробиология и антимикробная химиотерапия. 2000;2(1):16-30.
- Основные компоненты для программ профилактики инфекций и инфекционного контроля. Материалы второго совещания неформальной сети по профилактике инфекций и инфекционному контролю в здравоохранении. 26—27 июня 2008 г. Женева, Швейцария. Доступно по: http://apps.who.int/medcinedocs/documents/s16342e/s16342e.pdf. Ссылка активна на 25.03.2015.
- Эпидемиологическое наблюдение: принципы организации и методы проведения. Под ред. Л.П. Зуевой. СПб. 2004;12-14.
- Beer R, Pfausler B, Schmutzhard E. Infections intracranial complications in the neuro-ICU patient population. Current Opinion in Critical Care. 2010;16:117-122. doi:10.1097/mcc.0b013e328338cb5f.
- Leistner R, Schröder C, Geffers C, Breier A.-C, Gastmeier P, Behnke M. Regional distribution of nosocomial infections due to ESBL-positive Enterobacteriaceae in Germany: data from the German National Reference Center for the Surveillance of Nosocomial Infections (KISS). Clinical Microbiology and Infection. 2014. doi:10.1016/j.cmi.2014.07.015.
- Kim B-N, Peleg AY, Lodise TP, Lipman J, Li J, Nation R, Paterson DL. Management of meningitis due to antibiotic-resistant Acinetobacter species. The Lancet Infectious Diseases. 2009;9(4):245-255. doi:10.1016/s1473-3099(09)70055-6.
- Korinek A-M, Baugnon T, Golmard J-L, van Effenterre R, Coriat P, Puybasset L. Risk Factors for Adult Nosocomial Meningitis after Craniotomy: Role of Antibiotic Prophylaxis. Neurosurgery. 2006;59(1):126-133. doi:10.1227/01.neu.0000220477.47323.92.
- McClelland S, Hall WA. Postoperative Central Nervous System Infection: Incidence and Associated Factors in 2111 Neurosurgical Procedures. Clinical Infectious Diseases. 2007;45(1):55-59. doi:10.1086/518580.
- Lozier AP, Sciacca RR, Romagnoli MF, Connolly ES. Ventriculostomy-related infections. Neurosurgery. 2008;62:688-700. doi:10.1227/01.neu.0000316273.35833.7c.
- Sonabend AM, Korenfeld Y, Crisman C, Badjatia N, Mayer SA, Connolly ES. Prevention of Ventriculostomy-Related Infections with Prophylactic Antibiotics and Antibiotic-Coated External Ventricular Drains: A Systematic Review. Neurosurgery. 2011;68:996-1005. doi:10.1227/neu.0b013e3182096d84.
- Van de Beek D, Drake JM, Tunkel AR. Nosocomial bacterial meningitis. N Engl J Med. 2010;362(2):146-154. doi:10.1056/nejmra0804573.
- Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care–associated infection and criteria for specific types of infections in the acute care setting. American Journal of Infection Control. 2008;36(5):309-332. doi:10.1016/j.ajic.2008.03.002.
- Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: Development and validation. Journal of Chronic Diseases. 1987;40(5):373-383. doi:10.1016/0021-9681(87)90171-8.
- Гланц C. Медико-биологическая статистика. Пер. с англ. М.: Практика. 1999.
- Zhan R, Zhu Y, Shen Y, Shen J, Tong Y, Yu H, Wen L. Post-operative central nervous system infections after cranial surgery in China: incidence, causative agents, and risk factors in 1,470 patients. European Journal of Clinical Microbiology & Infectious Diseases. 2013;33(5):861-866. doi:10.1007/s10096-013-2026-2.
- Williamson RA, Phillips-Bute BG, McDonagh DL, Gray MC, Zomorodi AR, Olson DM, James ML. Predictors of extraventricular drain–associated bacterial ventriculitis. Journal of Critical Care. 2014;29(1):77-82. doi:10.1016/j.jcrc.2013.08.012.